药学院张海涛课题组在Nature communications报道药物靶标组胺H3受体拮抗剂作用的结构机制
组胺(Histamine)是一种内源性生物胺,通过作用于G蛋白偶联受体(G protein-coupled receptor,GPCR)家族中的四种不同的组胺受体(H1R、H2R、H3R、H4R)介导多种生理和病理过程。组胺H1受体(H1R)和组胺H2受体(H2R)分别与过敏反应和胃酸分泌相关,而组胺H4受体(H4R)主要参与机体的免疫反应。组胺H3受体(H3R)主要存在于脑部的组胺能神经元上,与睡眠、觉醒、学习和记忆、食欲及脑缺血生理过程相关,因此是治疗睡眠性疾病、阿尔兹海默疾病、精神分裂症、心肌缺血以及肥胖的潜在重要药物靶标。目前H3R拮抗剂中仅Pitolisant被批准用于治疗嗜睡,而多数拮抗剂因心脏毒性、磷脂质病等副作用终止于临床实验,所以需要优化和设计新的靶向H3R药物。
2022年10月15日,浙江大学药学院张海涛研究员团队在国际顶尖期刊《Nature Communications》上发表了题为“Structural basis for recognition of antihistamine drug by human histamine receptor”的研究论文。该研究利用蛋白质晶体学方法,解析了人源组胺受体H3R与拮抗剂PF-03654746的复合物晶体结构,结合计算和功能实验结果,系统地阐明了拮抗剂PF-03654746和变构调节分子胆固醇的独特结合模式以及不同拮抗剂的保守结合模式,为基于H3R的药物设计提供结构基础。

研究团队利用蛋白质晶体学技术,解析了2.6 Å的H3R与拮抗剂PF-03654746的复合物晶体结构。研究发现PF-03654746占据相对狭窄的配体结合口袋,靠近胞外部分有一个由TM2、TM7和ECL2组成的延伸的结合口袋,分子对接阐明了H3R拮抗剂的保守结合模式。H3R结构中发现TM1和TM7之间结合了一个胆固醇分子,该分子的结合有助于配体的结合并且通过疏水和静电相互作用影响受体构象。进一步通过与已知的H1R结构比较,揭示了H3R拮抗作用的结构机制。
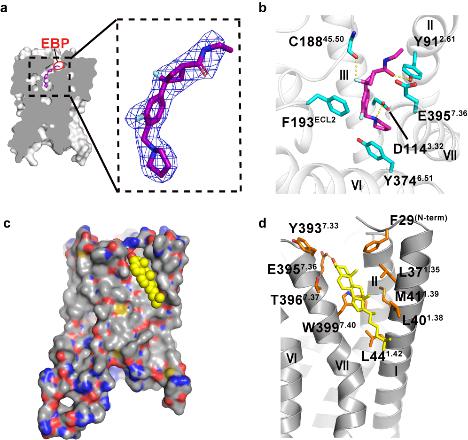
PF-03654746和胆固醇作用于H3R的分子机制
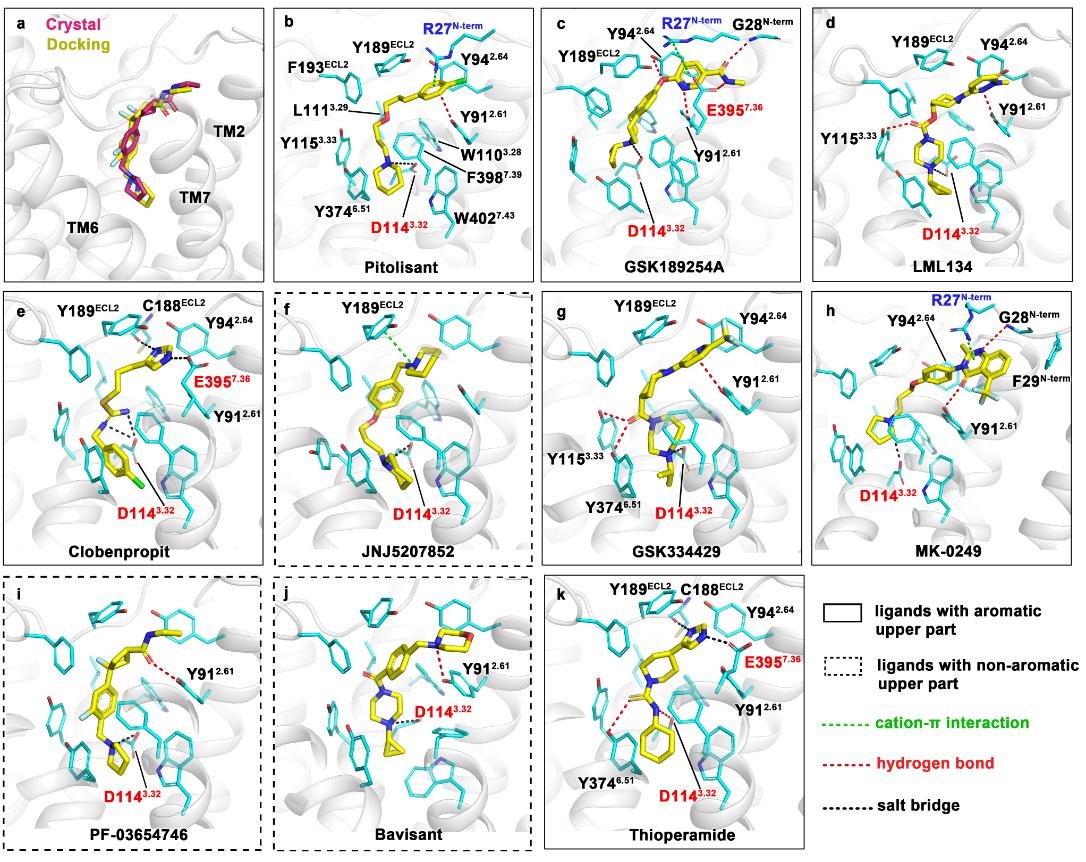
不同拮抗剂作用于H3R的分子机制
本文第一作者为浙江大学药学院博士研究生彭学谦,通讯作者为浙江大学药学院张海涛研究员。浙江中医药大学陈忠教授、郑州大学杨琳琳教授、上海同步辐射光源秦文明研究员分别为本研究的功能分析、计算分析、晶体X射线衍射数据收集提供了大力帮助。本课题受到国家重点研发计划、国家科技重大专项和国家自然科学基金等项目的支持。
原文链接:https://www.nature.com/articles/s41467-022-33880-y


