药学院杜永忠教授课题组在ACS Nano报道一种载鲁米诺铁蛋白自发光激活光敏剂促进肿瘤组织深层渗透的肿瘤治疗新策略
2021年11月22日,浙江大学药学院杜永忠教授课题组在ACS Nano发表题为“A Luminol-Based Self-Illuminating Nanocage as a Reactive Oxygen Species Amplifier to Enhance Deep Tumor Penetration and Synergistic Therapy”的研究论文。论文报道了一种基于鲁米诺的铁蛋白活性氧放大器,通过产生自发光激活光敏剂以扩大活性氧产量,进而破坏肿瘤微环境中致密的细胞外基质(ECM)实现肿瘤的深层渗透,并在被肿瘤细胞内化后以多途径协同杀伤肿瘤细胞,为肿瘤深层渗透和精准治疗提供了一种新的策略。

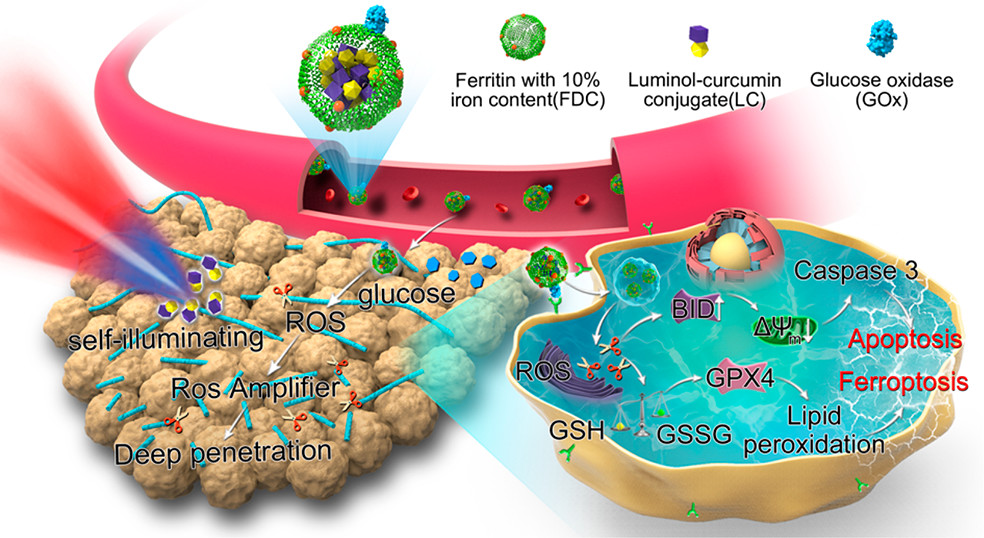
肿瘤组织中致密的ECM是限制纳米给药系统深入肿瘤的重要原因。为解决这类问题,已开发了基于ECM降解酶的药物递送系统,但由于酶的特异性和肿瘤ECM的异质性,单独使用胶原酶或透明质酸酶治疗后,纳米给药系统深层渗透的结果喜忧参半。活性氧是具有多种生物活性的内源性自由基,适量的活性氧可以促进细胞免疫、修复和生长。相反,过量的活性氧具有许多破坏特性,例如:可直接破坏ECM网络中的结构蛋白,使基质疏松并迅速降低间质液压力,还可激活基质金属蛋白酶,进一步加速ECM的降解等。因此,能够产生活性氧的药物输送系统可以作为摧毁ECM网络和降低间质组织压力的武器,促进其深层渗透。近年来,产生活性氧的主要手段是使用外在光源照射活化光敏剂。然而,外源性光线的穿透深度常受限制。因此,迫切需要开发新的药物递送系统,使其能受肿瘤组织中的内源性物质激发产生自发光,从而激活光敏剂并产生大量活性氧破坏ECM,帮助它们渗透到肿瘤深部。
本研究在前期工作的基础上,针对上述矛盾,设计了一种基于鲁米诺的铁蛋白纳米笼,可望在肿瘤内部建立自发光平台,实现肿瘤的深层渗透。这种纳米笼可以通过铁蛋白的介导,大量蓄积于肿瘤组织;而后铁蛋白表面修饰的葡萄糖氧化酶消耗肿瘤组织中的葡萄糖,实现饥饿治疗,并产生活性氧;产生的活性氧激发鲁米诺自发产生蓝紫光,能量共振转移至光敏剂,放大活性氧的产生;大量活性氧有助于破坏ECM以穿透至肿瘤的深层区域,还可在被细胞内化后继续产生活性氧,诱导凋亡、铁死亡和饥饿等多途径协同抗肿瘤,实现肿瘤的安全高效精准治疗。
本课题受到国家自然科学基金项目和博士后基金项目的支持。本文第一作者为浙江大学药学院徐晓玲博士,通讯作者为浙江大学药学院杜永忠教授和浙江大学丽水医院纪建松教授。
原文链接:https://pubs.acs.org/doi/pdf/10.1021/acsnano.1c05891


