药学院陈枢青教授团队研发靶向治疗耐药恶性肿瘤的新型“生物导弹”
2021年9月3日,浙江大学药学院陈枢青教授与“百人计划”研究员潘利强研究团队在Nature出版集团旗下期刊Signal Transduction and Targeted Therapy 在线报道了最新研究成果——“多价双表位抗EGFR纳米抗体-药物偶联物 (multivalent biparatopic EGFR-targeting nanobody drug conjugate)(图1),用于恶性肿瘤的靶向治疗。研究团队通过抗体工程改造,将两种靶向EGFR的纳米抗体串联,并与细胞毒素定点偶联,制备了一款多价、双识别表位的抗体偶联药物,实现了该生物药物的抗肿瘤活性增强以及解决了基因突变恶性肿瘤对传统单抗(如西妥昔单抗)的耐药问题,为恶性肿瘤的靶向治疗提供了生物技术药物方向的解决方案。
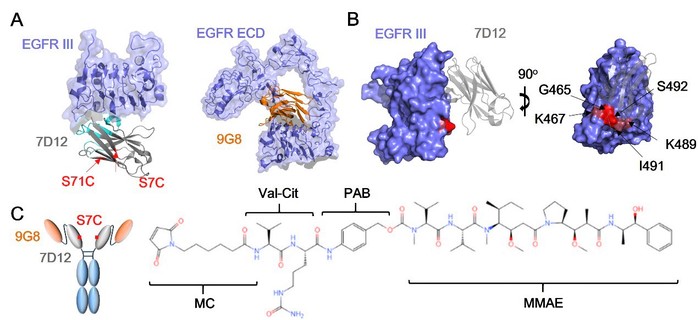
图1:抗EGFR 纳米抗体-药物偶联物的设计
抗体偶联药物(antibody drug conjugate,ADC)是一类将抗体和细胞毒性小分子药物相结合的抗体修饰类药物,结合了抗体的靶向性和化疗药物的杀伤性于一身。靶向EGFR的ADC通过靶向细胞表面抗原后内化进入细胞内溶酶体中降解这一途径,可以特异性的将细胞毒性小分子递送至EGFR阳性肿瘤细胞胞浆,从而克服因EGFR下游信号通路基因突变所导致的部分靶向药物耐药现象。在此项研究中,研究人员尝试构建了一种四价形式的双表位抗EGFR ADC,由两种具备不同抗肿瘤活性机制的纳米抗体融合而成,因此表现比西妥昔单抗更优异的内吞效率,可更有效地将小分子毒素递送进入肿瘤细胞内部发挥作用。该新型ADC还可以克服临床上常见的因EGFR胞外区氨基酸点突变导致西妥昔单抗以及帕尼单抗耐药的一系列突变位点,具备较好的治疗应用前景。
此外,本研究在确认该种形式的抗体相比传统抗EGFR抗体可以更有效激活补体依赖的细胞毒性(complement dependent cytotoxicity,CDC)的同时,还尝试对抗体的Fc段进行改造以进一步增强其CDC效应,从而形成一种CDC强化型ADC药物(图2)。CDC效应和ADC的小分子杀伤起效时间不同,本研究首次尝试探究CDC强化是否能应用于ADC药物中,发现这类CDC增强型的EGFR靶向ADC药物可以发挥更好的抗肿瘤活性,拓宽了ADC药物的设计思路。
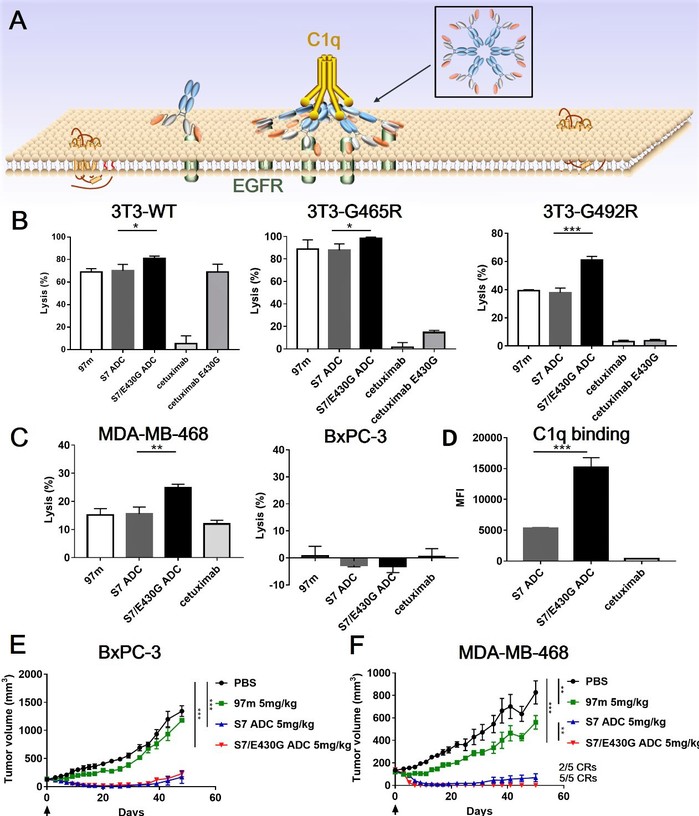
图2:新型抗体偶联药物的体内抗肿瘤活性
本研究报道了一种新型的ADC形式,显著增强了抗体偶联药物作为“生物导弹”的靶向抗肿瘤活性,同时助力解决EGFR靶向治疗中常见的基因突变(胞外区)耐药,有望在成药后为恶性肿瘤患者提供更多用药选择。本课题受到国家自然科学基金、国家科技重大专项和国家高层次青年人才项目,浙江省重点研发计划等项目的支持。本文第一作者为浙江大学药学院2016级博士生樊建声,通讯作者为浙江大学药学院陈枢青教授和潘利强研究员。


