冯友军课题组Cell Reports发文在细菌耐药机制研究中取得新进展
2021年5月18日, 浙江大学基础医学院冯友军课题组与浙江大学药学院侯廷军教授合作,在粘菌素耐药的分子机制方面取得了新进展,相关研究成果在CELL子刊Cell Reports发表题为“The MCR-3 Inside Linker Appears as a Facilitator of Colistin Resistance”的研究长文。

病原细菌的耐药性是全球所面临的公共卫生领域的重大威胁,其中发展中国家(包括印度和中国)已发展为重灾区。多粘菌素是一类阳离子型抗生素,在耐药细菌的抗感染治疗中,作为最后一道防线发挥关键作用。通过质粒传播的MCR粘菌素耐药酶的凸现与蔓延业已有席卷全球之势,对粘菌素的临床效果构成了严重挑战(Trends Microbiol,2018)。自从2015年沈健忠院士团队在我国南方率先发现MCR-1阳性质粒以来,MCR-1的新型变异体不断涌现(MCR-2至MCR-10),已构成了一个不断壮大的耐药基因家族(Trends Biochem Sci,2019)。MCR耐药家族的凸现引起了广泛关注,在学术界掀起了一股研究热潮。
MCR-1属于五次跨膜的整合性膜蛋白家族(JBC,2018),其C端定位于周质空间发挥着PEA-类脂A转移酶的活性(mBio,2017)。从细菌“脂代谢”这一独特视角,冯友军课题组开展了MCR耐药的机制研究(PLoS Pathog,2016)。该课题组较早发现了腹泻病人肠道细菌所携带的不同类型MCR-1阳性质粒(mBio,2016),通过基因组流行病学研究进一步夯实了“MCR-1的质粒传播多样性/复杂性”这一学术假说(Microbiome,2017)。继阐明MCR-1耐药的遗传学基础后,课题组亦揭示了天然粘菌素耐药EptA与获得性耐药MCR-1/2的保守机制(mBio,2018)。通过与中山大学田国宝教授合作,探明了MCR家族新亚型MCR-3在中国的分布与催化机制(EBioMedicine,2018)。联合四川大学宗志勇教授团队,课题组报道了嗜水气单胞菌所携带的大型MCR-5阳性质粒,并指出了MCR耐药家族“来源迥异,功能统一”这一科学假说(Adv Sci,2019a)。
为探明MCR家族的进化来源,课题组开展了大规模的系统生物学探索: 1)确定了莫拉细菌天然粘菌素耐药基因ICR-Mo,故其很可能是MCR-1/2的天然存储(PLoS Genet,2018); 2)发现海洋希瓦氏菌的染色体携带了MCR-4的进化前体,通过渐进式进化获得MCR-4的催化能力(Commun Biol, 2019),进而提出了一类内源性/非移动粘耐药基因家族NMCR-1(Adv Sci,2019b);3)通过系统分析MCR-8的生化基础与耐药表型,定义了非移动性粘菌素耐药原件NMCR-2即为MCR-8的进化前体(Environ Microbiol,2021a)。新近,课题组亦发现了另一类防线类抗生素,即替加环素的新耐药基因亚型Tet(X6)与MCR-1通过单一质粒共同传播产生共抗性的分子机制(Environ Microbiol,2021b)。
虽然上述研究拓展了对MCR耐药酶催化机制的认知,然而对于其“缘何以较低比例从众多毫无耐药能力的PEA-类脂A转移酶家族中进化获得耐药能力而成为MCR亚类”这一科学问题,我们当前知之甚少(图1)。
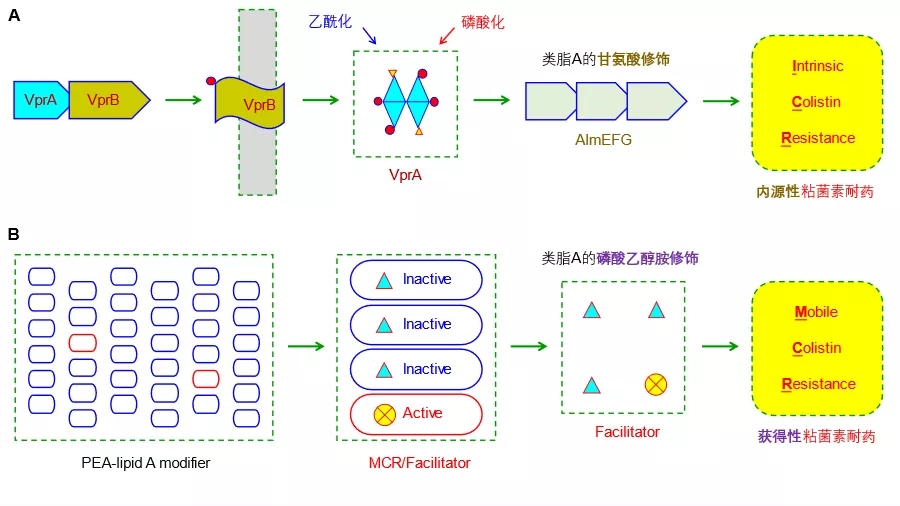
为探明这一分子进化机制,冯友军课题组联合侯廷军研究组利用分子对接/分子动力学模拟手段展开了系统研究。首先,通过对嗜水气单胞菌的比较基因组分析,发现了其通过“基因复制/扩增的过程产生MCR-3的功能性变体Ah762(MCR-3.12)”这一不同寻常的罕见例子。基于分子对接的结构-功能分析首次勾勒了MCR-3.12的底物类脂A结合口袋。令人惊讶的是,该课题组发现位于跨膜区与催化结构域之间的59个氨基酸长度的铰链区(命名为铰链区-59)决定了MCR-3粘菌素耐药能力(图2)。通过整合遗传学与生化表征,进一步揭示了该铰链区-59俨然扮演了促进器(Facilitator)的角色,可激活无酶活的MCR变体,使其重获粘菌素耐药能力(图2)。
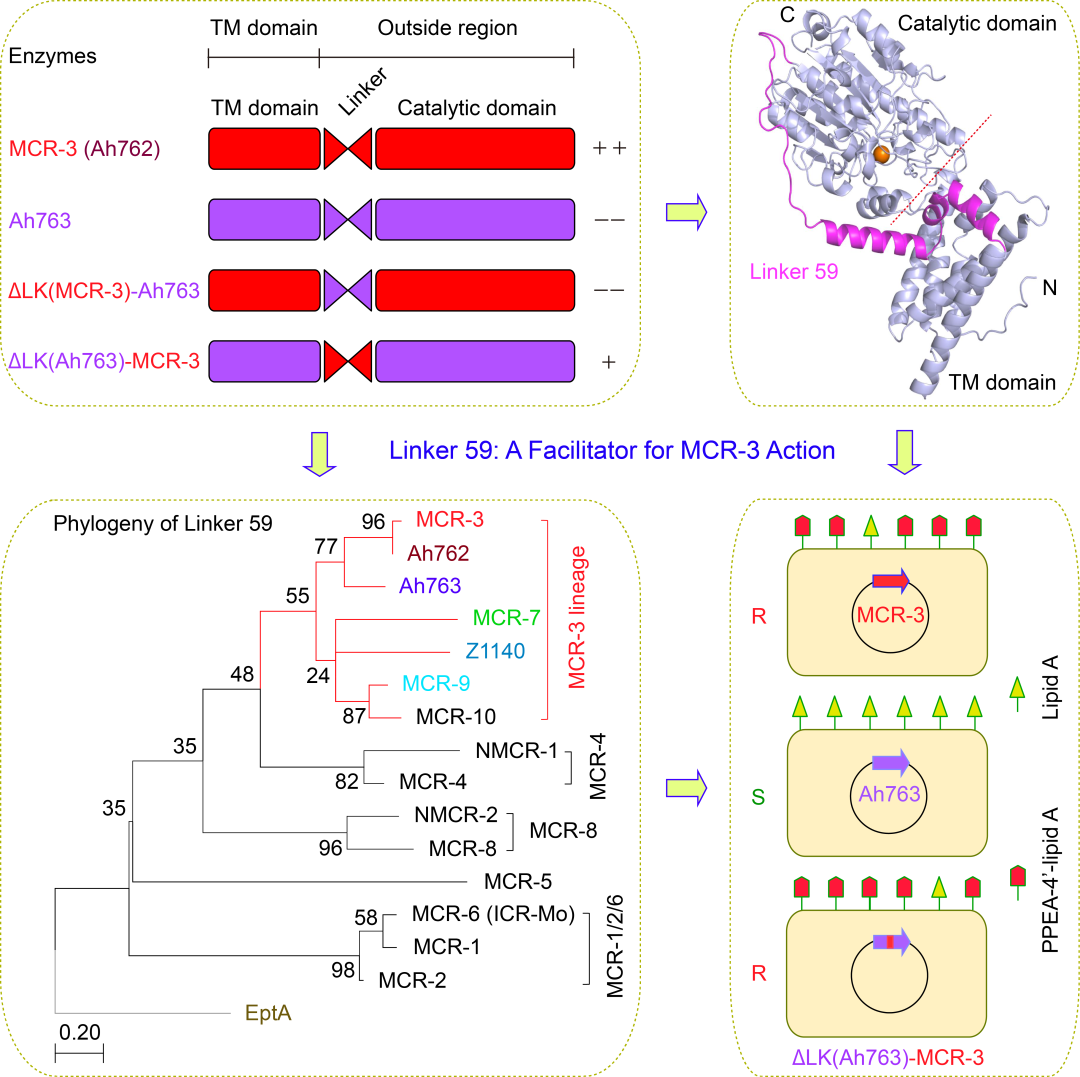
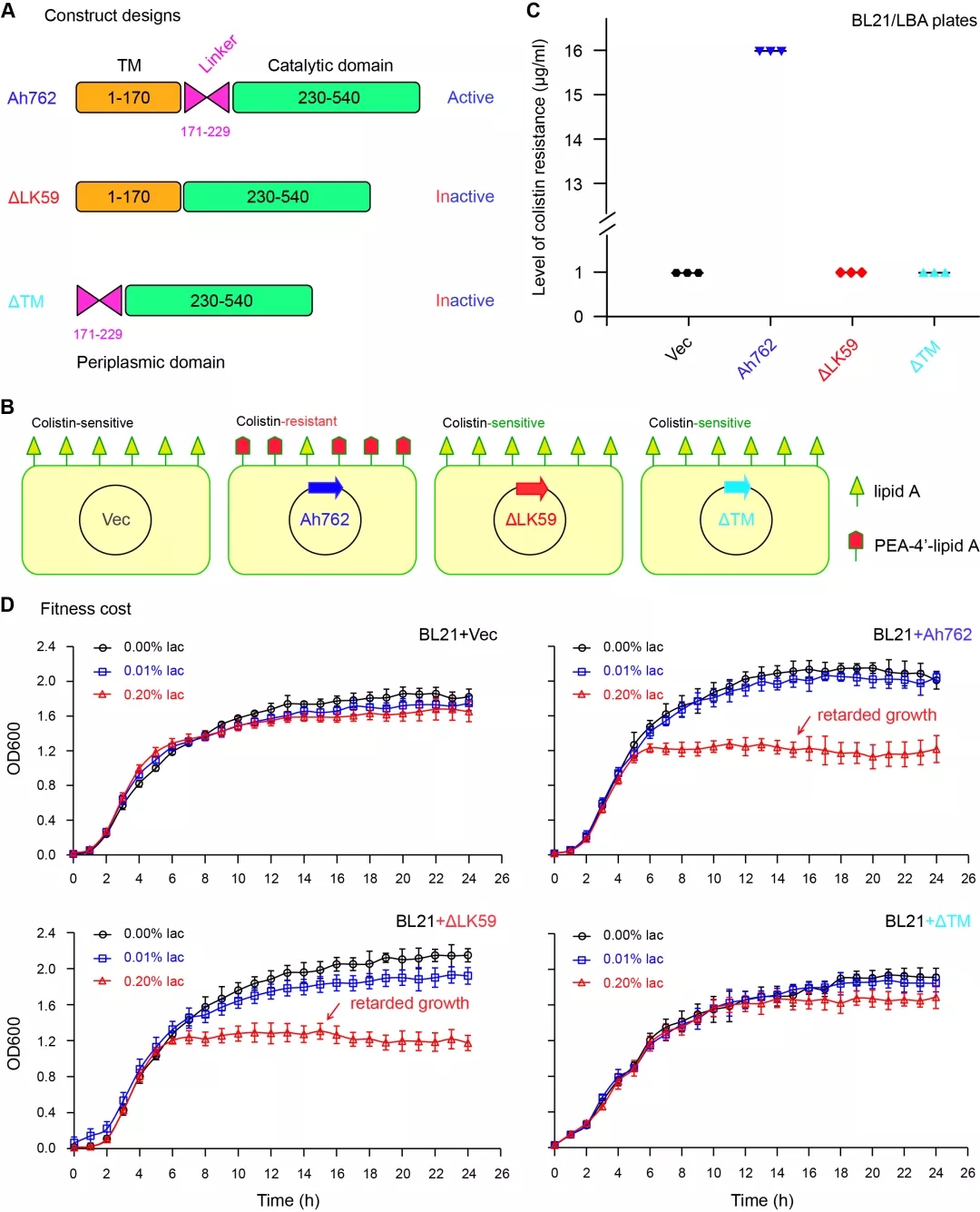
相较于跨膜区TM决定了MCR-3耐药酶的代偿损失,该铰链区-59并未参与其中(图3)。
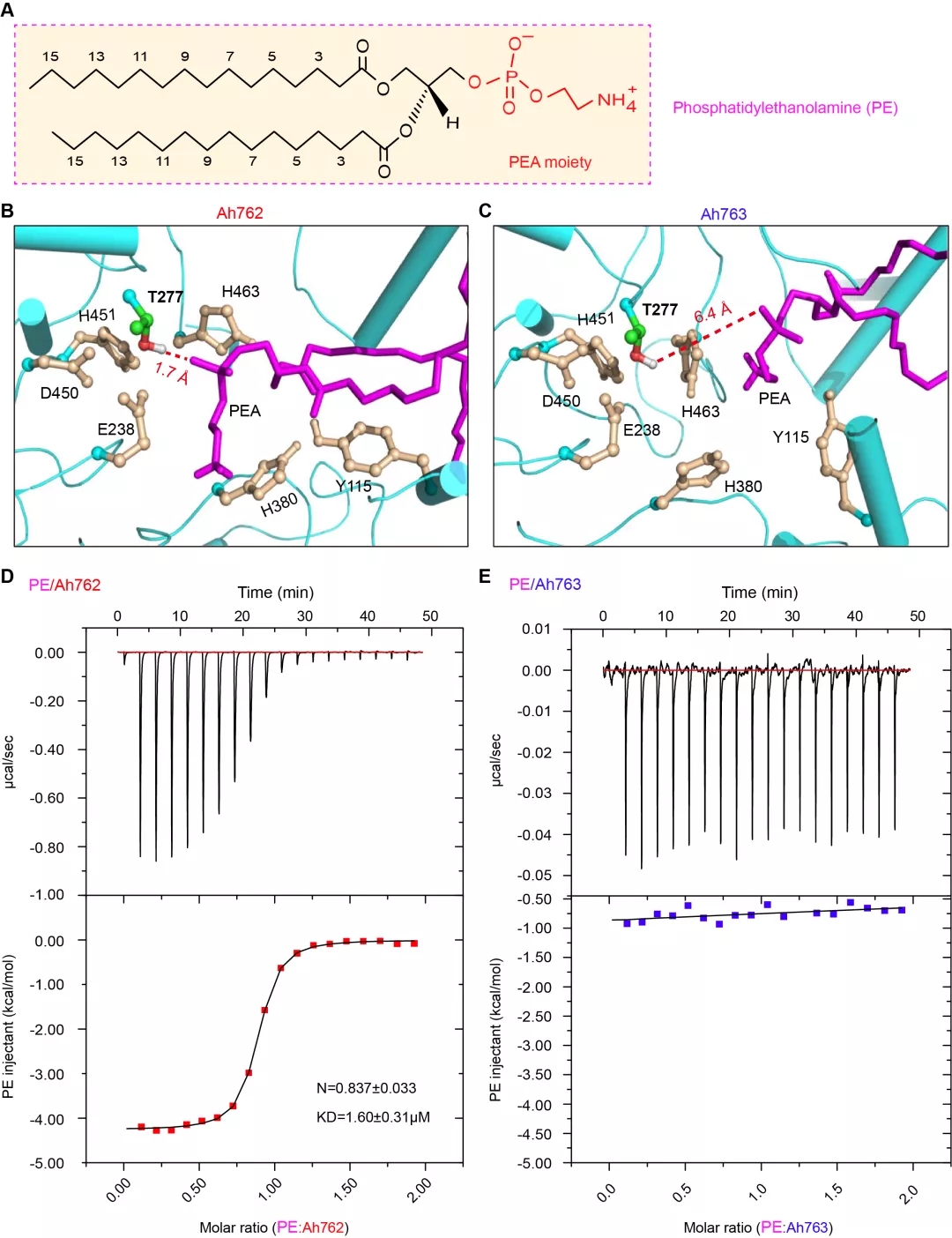
MD分子动力学模拟与ITC等热滴定的交叉分析提示该“促进器/铰链区-59”在结构上促进了MCR-3耐药酶的PE底物分子结合口袋的形成(图4)。
该发现首次定义了一个MCR-3内置的耐药决定原件。更为重要的是,该研究成果有希望为逆转粘菌素耐药的新靶点发掘提供新思路与新方法。
该研究得到了国家自然科学基金重点项目和国家重点研发计划的联合资助。本研究中进化分析溯源的相关内容得到了中科院南海海洋研究所高贝乐教授的鼎立协助。浙江大学基础医学院冯友军教授与浙江大学药学院侯廷军教授是该研究论文的共同通讯作者。


