张兴/朱永群课题组Cell发文揭示细菌鞭毛马达结构、组装与扭矩传输机制
2021年4月20日,我院张兴教授实验室和生命科学研究院朱永群教授实验室合作在Cell杂志在线发表了题为“Structural Basis of Assembly and Torque Transmission of the Bacterial Flagellar Motor”的研究论文,解析了来源于病原菌沙门氏菌(Salmonella Typhimurium)的天然状态下的鞭毛马达-接头装置复合物(Flagellar motor-hook complex)的原子分辨率冷冻电镜结构。该结构共含有12种不同的蛋白,共计175个亚基,总分子量超过6.3 MDa。该研究首次向人们展示了鞭毛马达的不同组件包括联动杆(rod)、外膜环(L ring)、周质环(P ring)、内膜环(MS ring)、分泌装置(export apparatus)以及接头装置(hook)在内的高分辨率结构,首次系统地揭示了鞭毛马达的组装和扭矩传输机制。
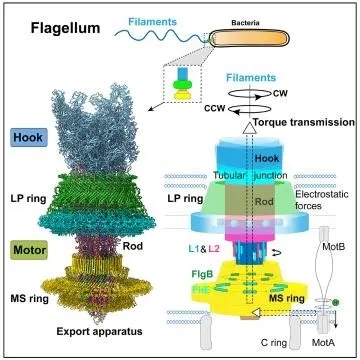
图1. 鞭毛马达结构与工作机制的示意图
细菌与其他生物具有漫长的生物共进化过程,这是一个相互斗智斗勇、趋利避害的竞争游戏。为了获得丰富的营养物质、避免被追杀,以及为了成功找到适宜的生存和感染的位置,细菌进化出了快速“游动”的能力。1秒钟可以跑出自己身长60倍、甚至100倍的距离,这是很多细菌具有的运动能力,远超地球上跑得最快的动物猎豹。自1676年列文虎克通过自己设计的显微镜,首次观察到能够移动的细菌后,细菌运动能力及其机制引起了广大的微生物学家、生物化学家、生物物理学家等研究人员的强烈兴趣。
细菌具有这种运动能力是因为拥有独特的运动器官—鞭毛。细菌鞭毛是一个巨大的纳米机器,在结构上由细菌膜上的马达(motor)、胞外的接头装置(hook)和鞭毛丝(filament)组成,横跨细菌的内外膜,延伸到细菌细胞外。鞭毛马达含有质子泵,通过转运氢离子,将化学能转变为机械能。鞭毛马达旋转并将扭矩传输给接头装置,然后传给鞭毛丝,从而带动鞭毛丝的转动。鞭毛丝如同螺旋桨一样,旋转推动细菌向前移动。
细菌鞭毛马达被认为是自然界中最高效、最精密的分子引擎,也是最复杂的蛋白质机器之一,能够每秒钟旋转300-2400圈。由于其高度复杂性,鞭毛马达一直是微生物学、生物化学、生物物理和结构生物学研究的难点。过去几十年,科学家们对鞭毛马达进行了大量的研究,包括预测组成成份、负染观察结构、荧光检测旋转规律等,对鞭毛马达进行了很多描述,然而其详细结构、组装机制和如何实现高效扭矩传输进而驱动鞭毛丝高速运转的工作原理依然很不清楚,是领域内长期没有解决的难题和挑战。
该研究首先通过同源重组基因敲除的方法,将沙门氏菌基因组上编码鞭毛丝蛋白FliC的基因和其帽子蛋白FliD的基因进行了敲除,排除鞭毛丝及其异质性和传统的酸碱处理法对鞭毛马达纯化的影响。经过大量的尝试,设计出了非常温和的鞭毛马达纯化步骤,最终获得了完整的、稳定的鞭毛马达与接头转置复合物样品,利用浙江大学300千伏冷冻电镜平台,首先解析了整体鞭毛马达-接头复合物的3.9 Å结构,进而对不同部位进行local refinement,最终将联动杆(rod)、外膜-周质环(LP ring)、内膜环(MS ring)、分泌装置(export apparatus)以及接头装置(hook)的局部分辨率达依次达到3.2 Å、2.8 Å、3.6 Å、3.2 Å和3.4 Å。
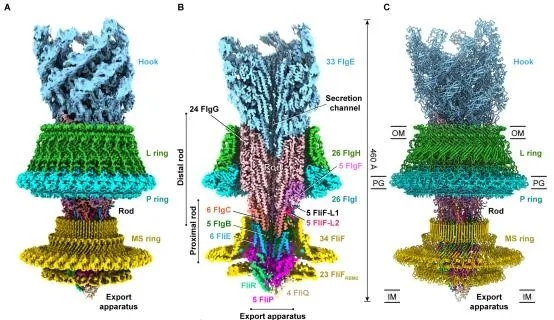
图2. 鞭毛马达总体结构
该研究有以下重要发现:
(1)天然状态下内膜环(MS ring)内部存在高度对称错位。内膜环是整个鞭毛马达的组装底座,它不仅可以旋转,而且可以接受来自质子泵和胞质区环传来的扭矩,并将扭矩传给联动杆(rod),而真实状态下MS ring的对称性长期以来具有争议。文章首次证实了天然状态下MS ring内部存在高度对称错位,其上部β-collar和 RBM3区具有C34的对称性,底部RBM2区采取C23对称性,而顶部伸出10个多肽链(5条L1链和5条L2链)。内膜环底部RBM2区紧紧地卡住分泌转置,β-collar和 RBM3包围分泌转置和联动杆下端。
(2)分泌装置(export apparatus)是联动杆的组装平台,并决定了联动杆的组装方式。分泌装置由5个FliP亚基、1个FliR亚基和4个FliQ亚基组成。分泌装置分泌各种鞭毛组装蛋白,逐步地形成联动杆,继而形成细菌胞外的接头装置和鞭毛丝。研究发现,联动杆通过下端FliE和FlgB的C端螺旋结构插入分泌装置内腔中,打开并激活分泌装置,而FliP和FliR向上嵌入FliE和FlgB之间的口袋里,FliP和FliR相互结合方式决定了FliE和FlgB的螺旋排列方式,而FliP、FliR与FliE和FlgB之间的相互紧密结合促使分泌转置和联动杆在马达工作时一同旋转。
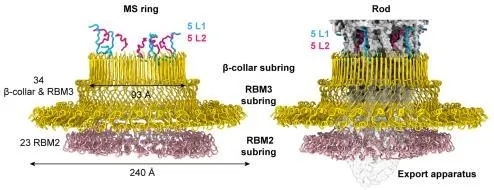
图3. 内膜环结构及与联动杆的相互作用
(3) 联动杆(rod)是由46个亚基组成、高度刚性的的螺旋杆状结构。先前科学家们利用同位素标记、质谱等手段试图分析rod的组成,但一直没有明确结论,甚至部分推论相互矛盾。该研究显示联动杆是非常致密的螺旋杆状结构,由5个蛋白、共46个亚基组成,其中远端rod(distal rod)是由24个FlgG和5个FlgF组成,而近端rod(proximal rod)是由6个FlgC,5个FlgB和6个FliE组成。不同的rod蛋白具有相似的基础特征,但各自具备特殊的结构特点。每个亚基跟周围的亚基相互锁定,保证了整个联动杆高度的刚性,特别是FlgG蛋白的GSS区形成类似 “楔子”的形状,插入远端rod表面的空隙中,极大地加强了rod的刚性,以保证rod的高速旋转和高效的扭矩传输。
(4)内膜环利用10条多肽链和FliE、FlgB亚基向联动杆传输扭矩,克服了马达内部的结构不对称性,实现了扭矩传输从水平到垂直方向的转换。联动杆通过近端的11个亚基(6个FliE和5个FlgB亚基),延伸出6个小螺旋结构和5个loop结构(环结构),牢牢地贴在内膜环的内表面上。反过来,内膜环伸出10条多肽链(5条L1和5条L2多肽链),紧紧地抓住联动杆的中部。这种相互作用方式克服了内膜环圆盘结构和联动杆的螺旋结构之间的结构不对称性,实现了扭矩传输从水平方向到垂直方的转换。多肽链与内膜环通过不规则的结构区连接,同样连接6个小螺旋结构和5个loop结构与联动杆近端的也是不规则的结构区,这些不规则结构区既保证了柔性,又充当了履带作用,从而将扭矩从内膜环传到联动杆上,然后致密的刚性联动杆进一步将扭矩从近端往远端传输。
(5)外膜环(L ring)和周质环(P ring)彼此相互紧扣,形成独特的桶状结构。外膜环由26个FlgH亚基组成,具有双层β-桶结构,顶端的α螺旋水平排列形成外膜结合区,而26个FlgH亚基进一步通过N端半胱氨酸上的脂肪基团锚定在外膜上。周质环由26个FlgI单体组成,FlgI单体呈现“V”字形,由D1和RBM1,RBM2三个结构域组成。这三个结构域依次形成了周质环的上、外、下三个亚环结构,彼此相互作用。外膜环和周质环通过FlgH和FlgI单体之间以“1 vs 4” 相互作用方式紧密结合,形成完整的、超稳定的C26对称桶状结构(简称“外膜-周质环”,LP ring),即使在鞭毛解聚后,仍稳定地存在在外膜上。
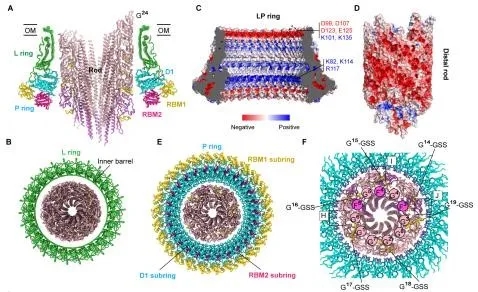
图4. 外膜-周质环结构及与联动杆的相互作用
(6)外膜-周质环使用静电斥力和恒定氨基酸残基形成的氢键环,确保了联动杆高速旋转时无摩擦和能量损耗。外膜环和周质环套在联动杆的远端,外膜环的内表面全带负电,正好与也全带负电的联动杆远端产生静电互斥,大大地减小了外膜环与联动杆之间的阻力,确保了联动杆的高速旋转。而周质环则围绕联动杆远端,与之形成一个氢键相互作用环。在联动杆远端的参与这个氢键相互作用环形成的氨基酸残基全部是固定的谷氨酰胺、谷氨酸、天冬酰胺等残基,而在周质环上参与这个氢键环的残基都是不变的赖氨酸和谷氨酰胺等残基,因而在联动杆旋转时,周质环与联动杆远端之间的氢键重建不需要能量的损耗,所以这个氢键环如同轴承中的钢珠球,既能保证联动杆高速旋转时不跑偏,而且不损耗扭矩传输中的能量。
(7)联动杆和胞外接头装置(hook)通过紧密的管状结构相连,保证了联动杆的扭矩全部传输给接头装置,进而带动鞭毛丝的转动。接头装置由蛋白FlgE组装而成,FlgE的D0-Dc、D1、D2结构域分别形成了接头装置的内、中、外三层管状结构。接头装置的内管和中管插入到联动杆远端的两层管中,通过疏水作用以及氢键相关交错结合,将联动杆和接头装置紧密地连接起来,保证联动杆的扭矩全部传输给接头装置,而接头装置的外管在外侧保护内管和中管的结构。由于FlgE单体的D0和Dc结构域较短,且D2结构域相对独立,接头装置具有一定的柔性,有利于联动杆到鞭毛丝之间的柔性过渡,接头装置的外管结构通过电荷互斥和空间限制与外膜-周质环的静电力作用一同精密地控制了联动杆组装长度。
细菌鞭毛是微生物学课本的基本内容,这项工作向人们揭开了鞭毛马达的神秘面纱。鞭毛马达通过独特结构和各个结构元件之间精妙的相互配合,将质子泵转化而来的机械能毫无损耗地迅速传给鞭毛丝,促进鞭毛丝高速转动,细菌得以快速运动。一位匿名评审专家说,这是一个里程牌的结构研究工作(represent a monumental structural effort)。另一位匿名评审专家表示,这是一件杰出的研究工作,它揭示了细菌鞭毛一些未知部分的无与伦比的高分辨率精细结构(This work is outstanding and gives unparalleled resolution on some of the least understood parts of the flagellum)。
细菌鞭毛马达结构与机制的揭示是微生物领域内的一个重要突破,而且研究还发现鞭毛马达的扭矩传输机制完全不同于自然界另一种分子马达ATP合成酶,说明自然界分子马达工作原理的多样性,有利于更好地了解微观世界的分子发动机。这项研究也为相关的合成生物学、生物物理学、纳米机器人等研究奠定了坚实的基础和提供了新的启发。
朱永群教授和张兴教授是本文的通讯作者,论文第一作者为朱永群实验室研究生谭加兴、博士后王小飞和张兴教授实验室研究生徐彩煌和张兴教授,参加合作的还有生科院高海春教授实验室和周艳研究员实验室。该研究工作获得了国家重点研发计划、国家自然科学基金委、浙江省自然科学基金委、中央高校基本科研业务费专项资金以及国家高层次人才万人计划的资助和支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S009286742100430X?via%3Dihub


