Blood Cancer Discovery| 那仁满都拉/许志宏联合团队提出热激特异性降解融合癌蛋白的新概念
急性早幼粒细胞白血病(APL)是急性髓性白血病中的M3亚型,通常由t(15;17)染色体易位产生的PML/RARα融合癌基因编码的PML/RARα(P/R)融合癌蛋白驱动。从上世纪七十年代开始,我国科学家张亭栋教授、王振义院士、陈竺院士及陈赛娟院士等研究团队率先提出应用三氧化二砷与全反式维甲酸攻击及降解PML/RARα(P/R)融合癌蛋白以治疗APL,使得患者的生存率大大提高,开创了小分子药物靶向治疗的先河,奠定了我国在APL治疗领域的国际领先地位。然而,部分APL患者在接受三氧化二砷治疗后由于P/R融合基因发生耐药突变而复发,此外也有一些患者本来对三氧化二砷及化疗药物有过度敏感性,目前对此类患者并无有效治疗手段。
2021年5月11日,浙江大学医学院那仁满都拉教授团队和许志宏研究员团队在美国癌症协会(AACR)重磅打造的新期刊Blood Cancer Discovery上在线发表了研究论文Hyperthermia Selectively Destabilizes Fusion Oncoproteins (https://bloodcancerdiscov.aacrjournals.org/content/early/2021/04/30/2643-3230.BCD-20-0188),首次提出了热疗通过特异性降解融合癌蛋白从而治疗癌症的新理论,为融合癌蛋白驱动的癌症治疗提供新思路,也为热疗疗法提供了更广阔的应用前景。

那仁满都拉教授研究团队长期从事三氧化二砷在白血病治疗中作用机理及难治性白血病的疗法研究。在这个工作中,该团队创新性地发现温和的热激即能够显著地诱导P/R融合蛋白的稳定性下降。更重要的是,对于目前无法处理的P/R蛋白耐药突变体,热激具有同样的作用。
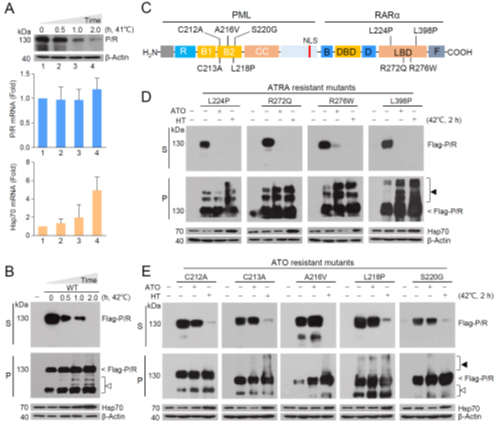
图1. 热激诱导P/R融合癌蛋白及其耐药突变体稳定性下降
目前已知APL发病机理中的关键环节之一为:P/R融合蛋白通过与核受体辅阻遏物(NCoRs)异常相互作用,从而招募组蛋白脱乙酰化酶(HDAC)、DNA甲基转移酶(DNMT)等表观修饰酶,进而抑制细胞分化及衰老相关基因的表达。研究团队发现热激能够特异性靶向P/R-NCoRs复合体,诱导该复合体不正常聚集并发生溶性改变,进而使其稳定性下降。若破坏P/R和NCoRs的相互作用(如构建不与NCoRs结合的P/R突变体、敲降NCoRs 蛋白或ATRA预处理解离P/R和NCoRs),热激则无法诱导P/R蛋白发生稳定性改变,证实NCoRs在热激降解P/R融合蛋白过程中起关键作用。研究团队进一步发现,热激能够增强E3泛素连接酶SIAH2与P/R蛋白的结合,而敲降SIAH2显著减少了热激诱导的P/R-NCoRs复合体的泛素化修饰,表明SIAH2参与了热激诱导P/R-NCoRs复合体泛素化,进而促进其主要通过自噬-溶酶体途径降解。

图2. 热激降解P/R融合癌蛋白的分子机制示意图
热激与三氧化二砷(ATO)造成的P/R稳定性下降机制不同。因此,团队将两者连用并发现热激和ATO在体内外均具有协同降低P/R蛋白稳定性的作用。在此基础上,那仁满都拉教授团队尝试性地对3例复发难治性APL耐药患者(包括1例PML和P/R双突变耐药患者、2例中枢神经系统复发患者)采用热疗与砷剂的联合疗法进行治疗,均在一定程度上缓解了病情并促进了相关治疗指标的改善。这些患者的临床数据强烈证明热疗与砷剂联合对传统疗法无效的APL砷剂耐药患者具有一定的治疗潜力。
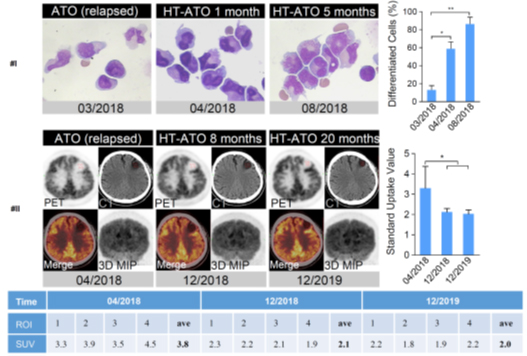
图3. 热激与ATO联用显著改善复发耐药APL患者的相关治疗指标
除了P/R融合蛋白之外,研究团队还发现热激能够下调其它融合癌蛋白稳定性,如AML1/ETO 和 TEL/AML1。综上,不同于传统的化疗、放疗及手术治疗,该研究不仅为目前临床上束手无策的复发难治性APL提供了无创伤、易于操作、非侵入式的新方案,还为其他由融合癌蛋白驱动的疾病提供了新的研究方向与治疗策略。
浙江大学医学院那仁满都拉教授课题组博士后亚森·买买提依明、王茜茜、杨畅为文章的并列第一作者。浙江大学医学院那仁满都拉教授和许志宏研究员为文章的共同通讯作者。
Blood Cancer Discovery期刊将本项工作选为焦点研究(Spotlight),并邀请法国科学院院士,APL领域国际顶尖学者Hugues de Thé教授为该科研成果撰写评论专文:PML/RARA destabilization by hyperthermia: a new model for oncogenic fusion protein degradation? (https://bloodcancerdiscov.aacrjournals.org/content/early/2021/05/07/2643-3230.BCD-21-0071)他对研究团队的工作给予了高度的评价,认为本团队所报道的研究结果以及提出的概念可为进一步研究热疗诱导的融合癌蛋白降解,尤其是是因分子量较大而易于错误折叠及聚集的融合癌蛋白降解铺平了道路。

在本期论文中,Maimaitiyiming及其合作者证明了热激诱导PML/RARA融合癌蛋白的稳定性下降作用是由核受体辅阻遏物(NCoRs)的聚集驱动的。热疗具有与ATO协同降解PML/RARA的作用,并能够克服ATO耐药。这种新颖的方法可以延伸应用于其他与NCoRs相关的融合癌蛋白中。
急性早幼粒细胞白血病是由t(15; 17)染色体易位产生的PML/RARA融合癌蛋白所诱导的。与许多其他融合癌蛋白类似,PML/RARA通过招募NCoRs进而重塑与白血病细胞自我更新、分化、衰老及凋亡相关的,甚至一些未知调节因子的表达。全反式维甲酸(ATRA)能够结合到PML/RARA的RARA部分,并进一步激活这些下游基因的转录活性,从而促进APL细胞分化以达到临床疗效。随后的研究发现,ATRA和ATO都能诱导PML/RARA的降解,而ATO对于早幼粒白血病细胞的清除至关重要。如今在APL的一线治疗中,ATRA和ATO联合应用已经成为了标准疗法,并能治愈超过95%的病人。因此, APL作为靶向降解癌蛋白成功治愈白血病的典型,激发了更多类似的清除癌细胞的新治疗策略。
在本期论文中,Maimaitiyiming及其合作者证明热激能够下调内源性PML/RARA蛋白。与ATO的作用类似,热激能够迅速地促进PML/RARA从可溶状态转变到不可溶状态。此外,ATO和ATRA耐药的PML/RARA蛋白突变体也都对热激敏感,提示热激与这些药物的作用机制不同。融合癌蛋白可能较易出现蛋白折叠异常,尤其是热激的条件下可能激活热休克蛋白(HSP)介导的蛋白质量控制机制。然而,热激诱导的PML/RARA聚集和降解不能被热休克蛋白抑制剂逆转,提示该降解机制是内质网非依赖性的。出乎意料的是,作者发现PML / RARA与corepressor(NCoR1和SMRT)之间的相互作用是热疗诱导PML / RARA聚集、核基质转移和后续降解的必需条件。因此,通过ATRA解离NCoRs与PML/RARA的相互作用能够抑制热激诱导的PML/RARA降解。PML/RARA、NCoR1和SMRT可能都是核基质关联蛋白,而核基质在生物化学上被定义为不溶性核物质。通过对热激诱导PML/RARA-NCoRs/SMRT复合物降解机制的探索,作者发现热激诱导该复合物聚集之后进一步促进其通过与NCoR结合的E3连接酶SIAH2发生多聚泛素化。然后,PML/RARA-NCoRs复合体主要是通过溶酶体还有一定程度的蛋白酶体途径降解。作者最终证明,ATO与热疗可协同促进PML / RARA降解。为了探索这种新型降解机制对耐药APL患者的治疗意义,作者设计了一种家庭用药方案,将口服砷与每天42°C的全身水浴结合。该方案稳定了一例具有PML和PML/RARA突变的复发APL患者的病情,该突变已知可导致ATRA和ATO的临床耐药。另有2例中枢神经系统复发的APL患者的研究结果也显示热疗与ATO联合应用对复发难治性APL具有有一定的疗效。
这些研究引出了许多有趣的生物学问题。PML/RARA为什么对热疗如此敏感?由于热激对野生型RARA没有作用,是否反映了PML在氧化应激下发生聚集的能力?PML/RARA可能由于同时定位于细胞核以及胞浆内从而能够经蛋白酶体和溶酶体途径降解。虽然一些自噬调节因子被证明定位于细胞核,大部分自噬过程还是发生于胞浆,SIAH2也主要定位于胞浆中。因此,热休克可能通过促使PML/RARA-NCoRs复合体的出核或抑制其入核来诱导其经自噬溶酶体途径降解。更普遍地说,这项研究表明热疗可能也会促使其他较大的或者与NCoRs相关的融合蛋白聚集并降解。AML1/ETO及TEL/AML1融合癌蛋白是辅阻遏物相关的转录抑制因子,并且可能与核基质相连。作者通过转染的AML1/ETO及TEL/AML1细胞进行初步实验,观察到了热激能促进这些融合癌蛋白的核基质转移。诱导融合癌蛋白的降解方式通常有受体配体结合、PROTAC或其他基于化学的干预措施。本团队所报道的研究结果以及提出的概念可以为进一步研究热疗诱导融合癌蛋白降解铺平道路,尤其是是因分子量较大而易于错误折叠及聚集的或与辅阻遏物相关的融合癌蛋白降解。这些令人兴奋的研究再次强调了APL是如何意想不到地开启了全新的生物学或临床研究的方向。


