浙江大学医学院附属邵逸夫医院孙继红团队在Science Advances发文阐述高效肿瘤免疫激活纳米药物杀伤肿瘤的新策略
癌症免疫疗法已在治疗多种癌症和提高患者生存率方面取得了巨大的成功。尽管如此,只有少数患有特定癌症类型的患者可以从当前的免疫疗法,如免疫检查点阻滞剂(immune checkpoint blockers, ICB)中受益2。特别要指出的是,患者对免疫疗法的反应和生存率与肿瘤微环境(TME)密切相关。 CD8+ T细胞高度浸润的、免疫学上的 “热肿瘤” 表现出对ICB免疫疗法的最佳反应。相反,患有 “冷肿瘤” 的患者──其特征是肿瘤中只有极少的CD8+ T细胞浸润──无法从ICB免疫疗法中受益,这提示我们迫切需要找到新的方法来将 “冷肿瘤” 转化为 “热肿瘤” 从而增强患者对免疫疗法的响应性。
浙江大学医学院附属邵逸夫医院放射科孙继红团队近期在Science Advances(IF=13.166)在线发表了题为”Nanoparticle-enhanced chemo-immunotherapy to trigger robust antitumor immunity”(https://advances.sciencemag.org/content/6/35/eabc3646)的研究论文,阐述了基于化疗药物为载体的肿瘤免疫激动剂纳米药物增强机体肿瘤免疫应答,促进肿瘤微环境(TME)中杀伤性免疫细胞浸润,将“冷肿瘤”转化为“热肿瘤”从而实现有效杀伤肿瘤的治疗策略。
临床前研究发现STING通路的激活与化学疗法和免疫疗法的效果相关,从而激发了将STING激动剂作为单一疗法或与免疫疗法结合的联合疗法的临床试验。从结构上讲,目前的STING激动剂由于极性高而无法顺利通过细胞膜,因此它们向细胞质的转运受到极大的限制。此外,由于缺乏特异的组织靶向性,大多数STING激动剂并不能用于系统性给药,取而代之的是瘤内注射的方式,这使得STING激动剂并不适用于患者身体深部的、转移性的和难治性的肿瘤。
该研究中,作者描述了一种新颖的策略:将化疗药物和DMXAA联合起来,合成了名为PS3D1 @ DMXAA的肿瘤微环境响应性三嵌段共聚物纳米颗粒,它能够通过静脉给药的方式将化学治疗剂SN38(7-乙基-10-羟基喜树碱)和STING激动剂DMXAA(5,6-二甲基黄嘌呤-4-乙酸)同时递送到肿瘤中来调节TME。作者通过体外细胞实验及小鼠肿瘤模型及体内抑瘤实验研究PS3D1@DMXAA增强小鼠肿瘤免疫及杀伤肿瘤的功能。
研究团队合成了肿瘤微环境响应性PS3D1@DMXAA的三嵌段共聚物纳米粒子,同时将化疗药物伊利替康的活性代谢产物SN38和STING激动剂DMXAA共输送到肿瘤中(图1)。
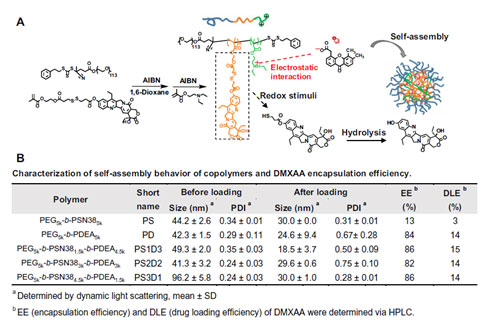
图1.PS3D1@DMXAA纳米药物设计及优化方案
PS3D1@DMXAA能显著提高DMXAA的胞内输送。体外免疫细胞活化实验证实PS3D1@DMXAA能有效增强树突状细胞(DC)及巨噬细胞活化,产生大量INFβ及CXCL10(图2)。
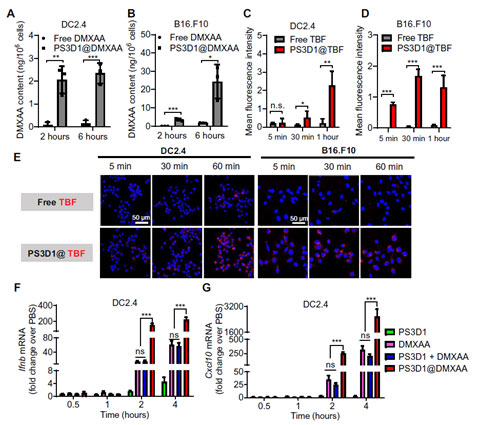
图2.PS3D1@DMXAA促进DMXAA的胞内转运和免疫刺激能力
研究人员通过进一步小鼠体内荷瘤治疗实验证实,PS3D1@DMXAA治疗显著抑制黑色素瘤和小鼠原位结直肠癌(图3)。最后,研究还发现PS3D1@DMXAA与经典免疫检查点抑制剂药物抗PD-1抗体联合治疗,相比于单一抗PD-1治疗,能显著延长黑色素瘤荷瘤小鼠的生存期(图4)。
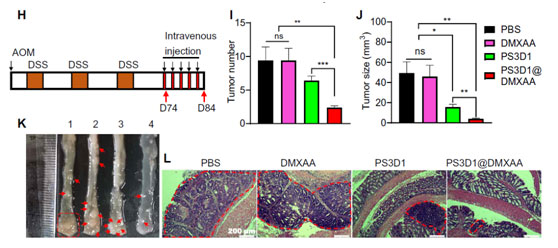
图3.PS3D1@DMXAA纳米药物抑制小鼠原位结直肠癌
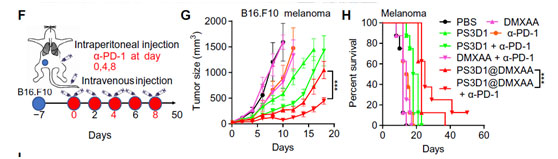
图4.PS3D1@DMXAA纳米药物联合抗PD-1疗法延长黑色素瘤生存期
作者的免疫机制研究结果表明,PS3D1 @ DMXAA通过一系列免疫相关事件放大了DMXAA的刺激活性并触发了 “冷肿瘤” 向 “热肿瘤” 的转变:1)PS3D1@DMXAA诱导的肿瘤细胞死亡和DCs成熟; 2)PS3D1诱导趋化因子CCL4的分泌,从而趋化CD103+ DCs的肿瘤浸润; 3)DMXAA诱导STING-I型IFN通路的激活,进一步增强CD103+ DCs的成熟及淋巴迁移;4)随后驱动肿瘤相关抗原(TAA)特异性CD8+ T细胞的交叉活化; 5)由趋化因子CXCL9 / CXCL10诱导的TAA特异性CD8+ T细胞的肿瘤浸润; 6)TAA特异性CD8+ T细胞促进肿瘤细胞的进一步死亡,并重新开启新一轮的抗肿瘤免疫反应,继续整个抗肿瘤的循环(图5),这一结论强调了结合化学疗法和免疫疗法的抗肿瘤二合一纳米颗粒的作用原理。总之,工程化纳米系统不仅为克服利用STING激动剂作为有希望的抗癌免疫疗法面临的障碍提供了范例,而且为合理的免疫疗法的联合方案提供了设计参考,这是癌症免疫疗法面临的十大挑战之一。
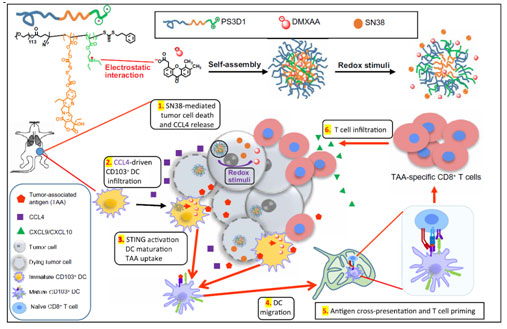
图5.PS3D1@DMXAA纳米药物增强肿瘤免疫机制示意图
浙江大学医学院附属邵逸夫医院放射科孙继红团队的博士后梁静静、浙江大学化学工程与生物工程学院生物纳米工程中心刘祥瑞副教授组的博士研究生王惠芳为论文共同第一作者。浙江大学院附属邵逸夫医院放射科孙继红,浙江大学化学工程与生物工程学院生物纳米工程中心刘祥瑞副教授及美国斯坦福大学程震教授为论文的共同通讯作者。
研究工作得到了多项国家自然科学基金、国家重点研发计划、浙江省重点研发计划、中国博士后科学基金等项目资助。
参考文献:
1. S. Kruger et al., Advances in cancer immunotherapy 2019 - latest trends. J Exp Clin Cancer Res 38, 268 (2019).
2. J. Galon, D. Bruni, Approaches to treat immune hot, altered and cold tumours with combination immunotherapies. Nat Rev Drug Discov 18, 197-218 (2019).
3. B. A. Flood, E. F. Higgs, S. Li, J. J. Luke, T. F. Gajewski, STING pathway agonism as a cancer therapeutic. Immunol Rev 290, 24-38 (2019).
4. T. Su et al., STING activation in cancer immunotherapy. Theranostics 9, 7759-7771 (2019).
5. Y. Liu et al., An inhalable nanoparticulate STING agonist synergizes with radiotherapy to confer long-term control of lung metastases. Nat Commun 10, 5108 (2019).
6. P. S. Hegde, D. S. Chen, Top 10 Challenges in Cancer Immunotherapy. Immunity 52, 17-35 (2020).


