Nat Metab:方向明团队揭示脓毒症心功能障碍的关键免疫细胞亚群的救治前景
2023年1月12日,方向明团队在Nature Metabolism上在线发表了题为 TREM2hi resident macrophages protect the septic heart by maintaining cardiomyocyte homeostasis 的研究论文。该研究揭示了脓毒症心功能障碍的关键免疫细胞亚群,发现TREM2hi的心脏常驻巨噬细胞具有维持心肌细胞线粒体稳态,救治脓毒症心肌病的潜在前景。论文发表同日,方向明团队应邀在Nature的Health Community中“Behind the paper”栏目撰文分享该项研究背后的故事(https://healthcommunity.nature.com/posts/trem2hi-macrophage-as-a-sicm-therapy-road-ahead-is-long-but-worthy?channel_id=behind-the-paper)。
脓毒症(sepsis)系宿主免疫失调并出现器官功能损伤。统计报道显示,在新冠前,全球每年大约有5000万新增脓毒症患者[1]。由于其病情恶化快,各组织器官会出现不同程度的损伤,如肺的氧合障碍、大脑的意识异常、循环的不稳定、胃肠蠕动抑制等。心脏的收缩舒张泵功能一旦受损,将引发脓毒症心肌病(sepsis-induced cardiomyopathy,SICM),各器官有效灌注难以维持,患者预后迅速恶化[2]。目前,SICM缺乏有效的治疗策略。患者需要依赖ECMO、人工心移植来短期维持生命功能,是脓毒症治疗的挑战。在2023年1月12日的Nature Metabolism期刊上,方向明团队发现的一类能清除心肌细胞损伤线粒体并维持心肌细胞代谢稳态的巨噬细胞亚群,将是改善脓毒症心脏功能的全新策略。
过去十年的研究显示,在免疫细胞中,组织驻留巨噬细胞(tissue resident macrophages,TRMs)无处不在,它们在数量和功能上都是健康心脏的重要组成部分,因此适合于对感染做出早期反应。事实上,心脏巨噬细胞的表型多种多样,它们的功能也与心肌的需求相匹配。在脓毒症期间,这些细胞是否会受到脓毒症的影响?它们如何受到脓毒症的影响?它们在SICM的病理过程中是否发挥着有效作用?这些都是值得探讨的问题。
在研究中,方向明团队发现,高表达髓系细胞触发受体2(triggering receptor expressed on myeloid cells-2,TREM2)的心脏常驻巨噬细胞与SICM病理过程密切相关。该团队采用盲肠结扎穿孔诱导SICM,并通过单细胞转录组学和流式细胞分析术阐述心脏免疫细胞亚群的动态变化。结果发现,高表达TREM2的心脏TRMs亚群在SICM中先减少后增加,Folr2、Lyve1、Cd163或Retnla等吞噬、免疫调控等相关基因富集,这种特殊的转录特征提示该类细胞可能对应于心脏TLF+巨噬细胞[4]。作为感染免疫非Toll样受体中的重要一员,高表达TREM2的巨噬细胞近来受到广泛关注,参与了神经退行性疾病和心血管疾病等的病程进展[3]。超声心动图和血浆代谢物测量结果表明,在脓毒症后第三天,小鼠心脏功能明显受损,随后逐渐好转。有趣的是,心脏中TREM2高表达的这一巨噬细胞亚群数量及比例变化与之一致,这说明TREM2hi巨噬细胞是与脓毒症心功能恢复密切相关的巨噬细胞。
为了深入探索TREM2介导该亚群发挥的作用,方向明团队应用大量的遗传模型和实验方法。TREM2基因敲除或TREM2hi巨噬细胞缺失导致心脏功能障碍加剧;心包内同种异体移植TREM2hi的该亚类免疫细胞可治疗脓毒症心功能障碍。研究提示,高表达TREM2的TRMs很可能成为SICM救治的新思路、新策略。
常驻巨噬细胞发挥着组织特异性功能以维持组织稳态,那么TREM2hi上标心脏巨噬细胞如何调节心脏功能呢?方向明团队发现,这些细胞的保护作用与它们清除心肌细胞释放的缺陷线粒体的能力密切有关。健康的免疫微环境在恢复心脏基本细胞功能方面,即心肌细胞的线粒体稳态和代谢功能维持方面,起着相当重要的作用[5]。健康的心肌细胞有其独特的线粒体质量控制机制,借助于直径约3μM的exophers这一细胞外囊泡,通过心肌细胞与巨噬细胞间互作清除损伤的线粒体。这种细胞间的传递-以前被称为“异噬”-在支持心肌细胞线粒体稳态方面提供了自体吞噬的替代方案[6]。由于心肌细胞耗能高,线粒体功能障碍成为了脓毒症心肌病期间的一个关键特征。方向明团队发现,脓毒症时TREM2高表达的巨噬细胞是心脏的“代谢卫士”,其数量和比例的减少会导致心肌中的Exophers、功能障碍的线粒体的积累。为证实这一理论,该团队构建了αMHCCre: Rosa26TdTom小鼠追踪心肌细胞来源的exophers,并通过αMHCCre: mtD2Flox/Flox心肌细胞线粒体特异性标记小鼠及AAV-Tnnt2-mtKeima心肌线粒体特异性标记病毒追踪心肌细胞来源的线粒体。结果发现,与其他巨噬细胞亚群相比,心肌细胞释放的exophers和线粒体优先被TREM2hi的巨噬细胞摄取,并且该过程受到TREM2调节(图1)。
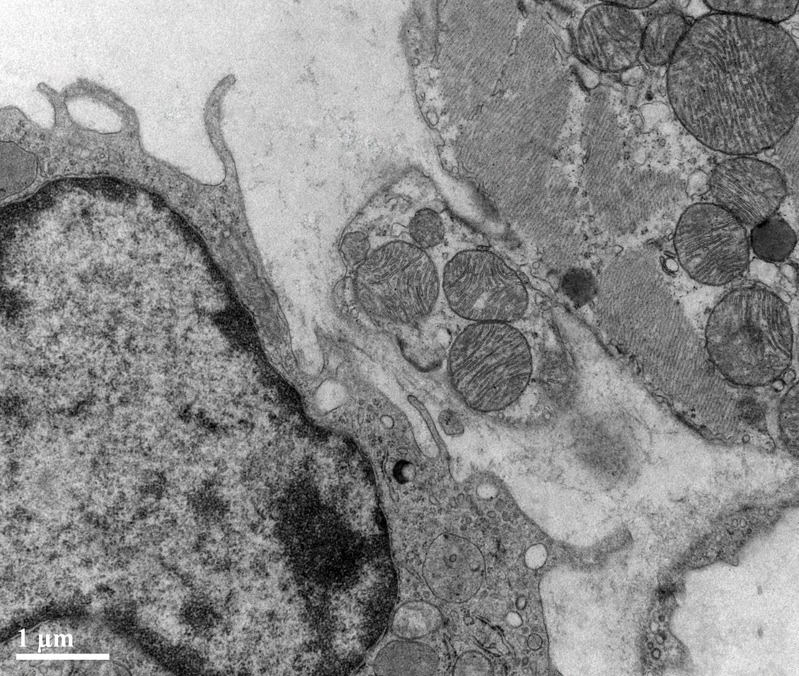
图1. TREM2hi的巨噬细胞摄取心肌细胞释放的内含损伤线粒体的exophers。
综上所述,该研究揭示了脓毒症心功能障碍的发病机制并提出了具有临床前景的治疗策略。该研究发现,以TREM2高表达为特征的心脏常驻巨噬细胞是脓毒症心功能恢复的关键细胞亚群。同时,该研究阐明了心脏常驻巨噬细胞通过清除心肌来源损伤线粒体来保护心肌细胞代谢的作用机制,最后通过心包腔细胞移植治疗SICM,为临床基于TREM2hi巨噬细胞开发新型治疗策略提供了无限可能(图2)。
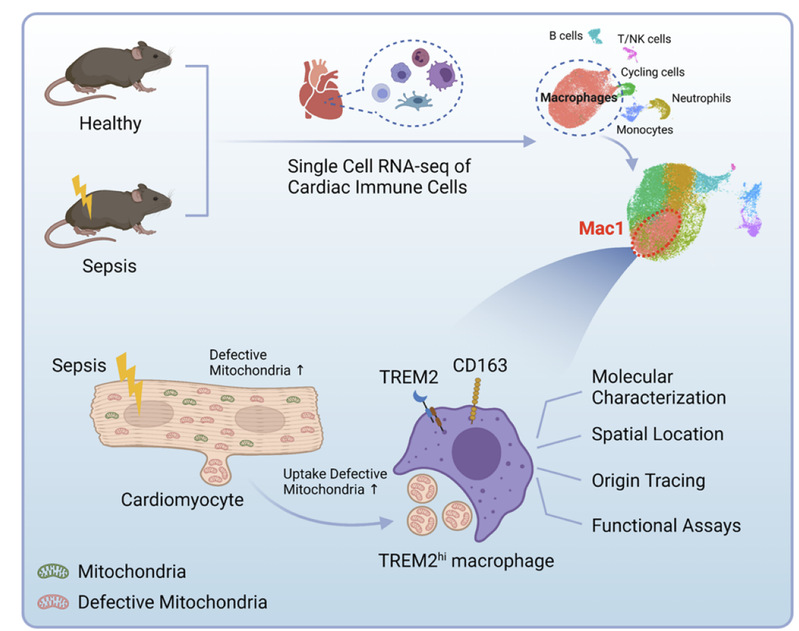
图2. 脓毒症心脏常驻巨噬细胞调控心肌细胞线粒体平衡的机制。
补充:浙江大学医学院附属第一医院张凯博士、博士研究生汪洋、陈诗昱、毛佳丽为该论文的共同第一作者。该项研究获得国家自然科学基金重点项目等经费资助。
参考文献
[1] Rudd KE, et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. Lancet. 2020;395(10219):200-211.
[2] Hollenberg SM, Singer M. Pathophysiology of sepsis-induced cardiomyopathy. Nat Rev Cardiol;2021;18(6):424-434.
[3] Hou J, et al. TREM2 sustains macrophage-hepatocyte metabolic coordination in nonalcoholic fatty liver disease and sepsis. J Clin Invest. 2021;131(4):e135197.
[4] Dick S, et al. AThree tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 2022;7(67):eabf7777.
[5] Swirski FK, et al. Cardioimmunology: the immune system in cardiac homeostasis and disease. 2018;18(12):733-744.
[6] Nicolás-Ávila JA, et al. A Network of Macrophages Supports Mitochondrial Homeostasis in the Heart. Cell. 2020;183(1):94-109.e23.


