药学院杜永忠课题组在Advanced Materials报道铁蛋白靶向前药用于时空定向内源性铁死亡协同抗癌治疗
铁死亡是一种铁依赖形式的调节性细胞死亡,其特征是脂质过氧化(LPO)的积累,作为一种新的癌症治疗策略潜力巨大。现有研究表明,LPO的产生源于生物介导的Fenton反应,该反应可以在铁催化下将内源性H2O2转化为•OH,这是毒性最大的ROS之一。因此,细胞内铁是铁死亡的基础。随着纳米技术的发展,各种铁基纳米材料,如氧化铁纳米颗粒、无定形铁纳米颗粒和铁有机框架,由于其能够递送外源性铁以激活肿瘤铁死亡,已显示出诱人的治疗优势。然而,过量使用外源金属可能对人类健康造成潜在的不利影响,包括急性和慢性损害。因此,迫切需要开发一种替代方法来诱导铁死亡。
2022年10月10日,浙江大学药学院杜永忠教授团队在Advanced Materials上发表了题为“Ferritin-hijacking Nanoparticles Spatiotemporally Directing Endogenous Ferroptosis for Synergistic Anticancer Therapy”的研究论文。该研究通过将铁蛋白归巢肽HKN15与光敏剂二氢卟酚e6(Ce6)结合,在不引入Fenton反应性金属的情况下,制备出一种铁蛋白劫持纳米颗粒 (Ce6-PEG-HKN15),用于内源性铁死亡,实现肿瘤的安全高效治疗。

研究团队通过自组装策略构建了无载体前药纳米颗粒(Ce6-PEG-HKN15 NP), 该纳米颗粒被肿瘤细胞内化后,可以靶向聚集在铁蛋白周围。在近红外光照射下,可活化Ce6、有效释放出活性氧(ROS)。丰富的ROS不仅可以介导铁蛋白破坏,促进内部铁的释放,激活内源性铁死亡,而且可以直接杀死肿瘤细胞。此外,细胞内过量的H2O2通过Fenton反应在铁催化下转化为O2,进一步增强光动力疗效、破坏肿瘤的抗氧化防御、放大氧化应激损伤。该研究结果显示通过时空破坏铁蛋白可有效激活内源性铁死亡,为铁死亡-光动力协同抗肿瘤治疗提供了新的启发。
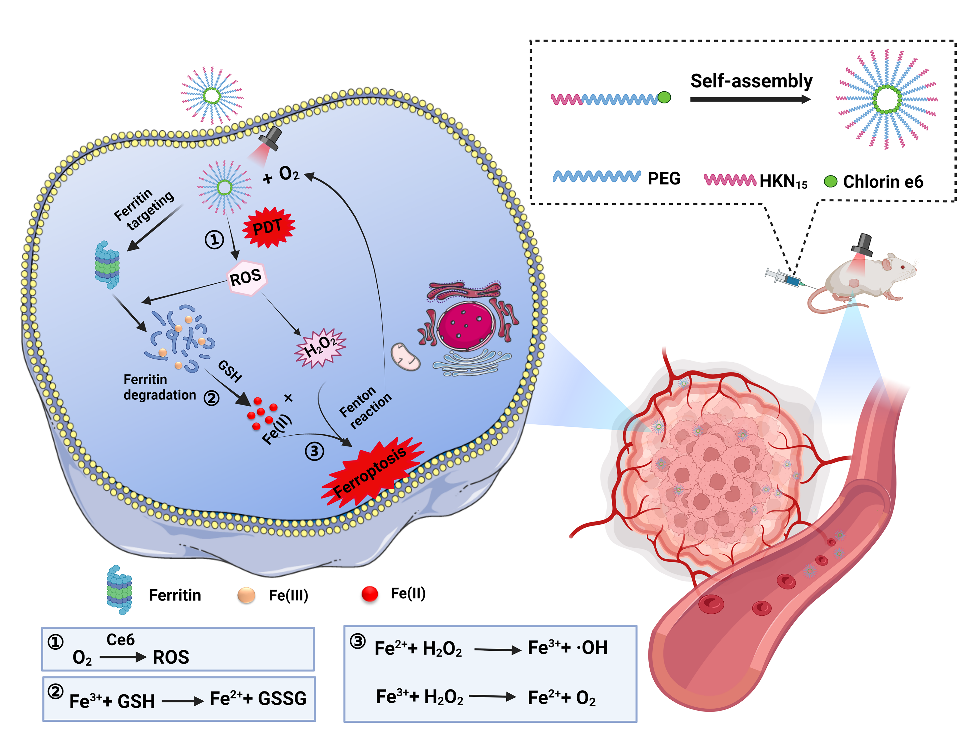
用于协同PDT和铁死亡治疗的铁蛋白靶向前药纳米颗粒及其抗肿瘤机制示意图
本文第一作者为浙江大学药学院博士研究生朱露雯,浙江大学医学院纪建松教授、浙江大学药学院杜永忠教授、浙江树人大学徐晓玲副研究员为共同通讯作者。本课题受到国家重点研发计划和浙江省自然科学基金等项目的支持。
原文链接:https://doi.org/10.1002/adma.202207174


