药学院陈枢青/潘利强团队在Nature Communications报道固定表位的抗体定向进化新方法克服获得性点突变耐药
EGFR是研究最深入的受体酪氨酸激酶之一,与多种癌症相关。基于该靶点已成功开发并上市多款酪氨酸激酶抑制剂(如阿法替尼)和单克隆抗体药物(如西妥昔单抗)。酪氨酸激酶抑制剂是靶向EGFR胞内激酶域的小分子靶向药物,在临床用药过程中患者EGFR胞内激酶域产生点突变(如T790M、C797S),从而破坏药物与靶标的结合是常见的耐药机制。针对这些点突变开发二代药物是新药研发的重要方向之一,且技术较为成熟。单克隆抗体药物则是靶向EGFR胞外区的大分子靶向药物,在临床用药过程中患者EGFR胞外区亦会产生一系列点突变从而对单抗药物产生耐药性,个别常见的单点突变(如S492R、G465R)甚至可使抗体完全丧失结合EGFR的能力,让患者陷入无药可用的窘境。但目前临床上缺乏对EGFR胞外区点突变的检测和克服耐药的解决方案。因此,开发能够克服靶标受体胞外区点突变耐药的抗体新药是迫切需要解决的临床问题。
2022年7月30日,浙江大学药学院陈枢青教授与百人计划研究员潘利强团队在Nature Communications在线发表了题为“Structure-guided and phage-assisted evolution of a therapeutic anti-EGFR antibody to reverse acquired resistance”的研究论文,报道了一种固定表位的抗体定向进化新方法克服获得性耐药点突变。

本研究使用结构引导和噬菌体辅助进化的方法(图1),有效实现了西妥昔单抗表位固定进化,并成功鉴定出具有最小点突变(1或2个氨基酸残基的突变)的西妥昔单抗突变体以逆转EGFR S492R或G465R介导的耐药性,最大限度保留了突变抗体的成药性,有望缩短新药研发周期。本研究同时提出了一种有效可行的克服单点突变驱动的耐药性的策略,该方法也具备有效进化其他结构信息已知的蛋白质的潜力,例如重组酶和细胞因子等;并且在结构生物学和蛋白质结构预测的快速发展下,该方法的潜力将进一步被激发。
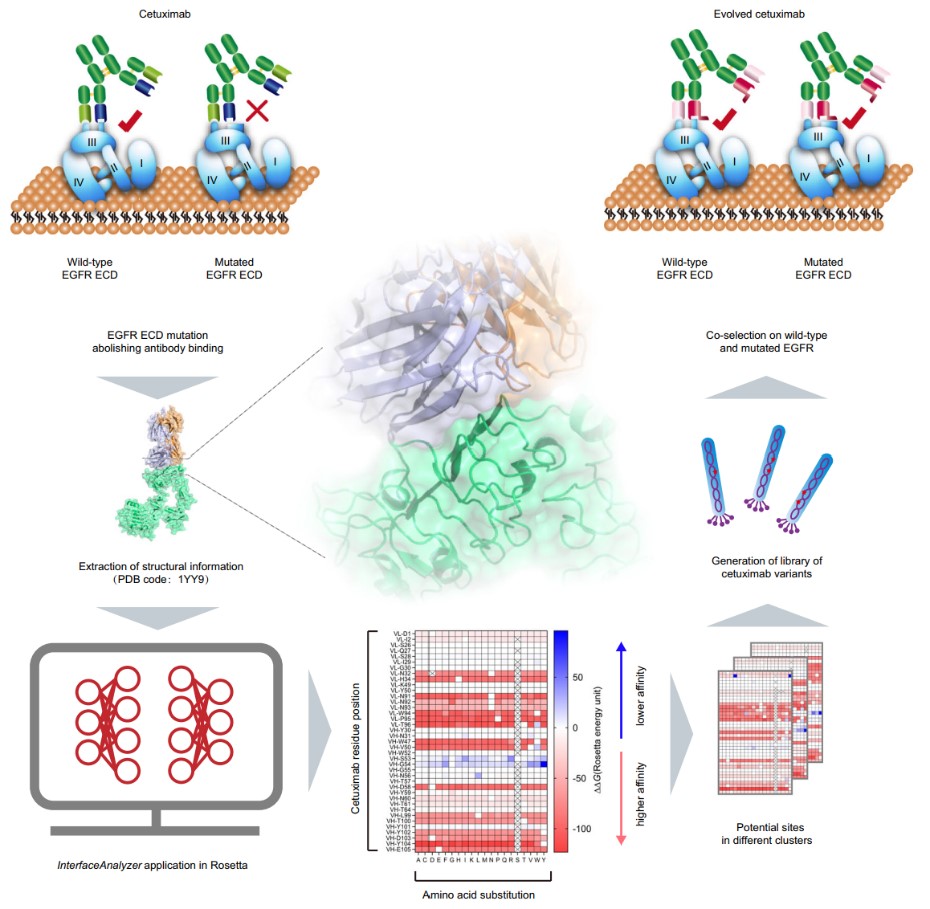
图1. 西妥昔单抗定向进化示意图
浙江大学药学院博士生庄鑫磊、博士后王哲为本论文共同第一作者,药学院百人计划研究员/浙大一院兼聘教授潘利强、药学院陈枢青教授为通讯作者。感谢药学院侯廷军教授为本研究计算生物学方面提供大力支持,哈佛医学院教授James J. Chou为本研究提供建设性意见。本研究受到国家自然科学基金重点项目、面上项目以及国家高层次青年人才项目、中央高校基本业务费、浙江省钱江人才等项目的支持。
原文链接:https://www.nature.com/articles/s41467-022-32159-6


