Nat Commun|转化医学研究院谢安勇教授团队揭示BRCA1缺陷肿瘤特征性突变模式发生来源与机制
肿瘤基因组测序解析出BRCA1缺陷肿瘤复杂的突变模式(Mutational Signatures),主要包括特异的成簇点突变富集、小片段碱基增删(InDel)、染色体易位形成,以及大量的约10 Kb的串联倍增(Tandem Duplication,TD);这些突变模式记录了肿瘤形成过程中细胞遭遇的DNA损伤事件和异常修复1,2。根据这些特征性的突变模式开发的同源重组缺陷(Homologous Recombination Deficiency, HRD)预测工具已用于临床预测癌症药物PARP抑制剂治疗响应3。然而,产生这些特征性突变模式的主要原因和具体分子机制目前尚不明确,大大限制了人们对肿瘤基因组不稳定性产生机制的理解,阻碍了以此为基础的肿瘤诊疗策略的开发4。
生理条件下细胞正常代谢产生的内源性DNA损伤是基因组不稳定性的主要元凶,其中 DNA单链断裂(Single Strand Break,SSB)是最频繁的DNA损伤,如果与DNA复制叉相遇会转换为单末端的DNA双链断裂(Double Strand Break, DSB)。由于缺乏第二个末端,此类DSB倾向于利用同源重组(Homologous Recombination,HR)完成修复。我们推测,BRCA1缺陷细胞中这类DSB的异常修复是产生BRCA1缺陷肿瘤特异性突变模式的主要原因。但由于缺乏定点、有效、均一的复制偶联的单末端DSB的诱导方式,针对该类型DSB的损伤应答和修复认知有限,BRCA1在其中的作用与机制也不清楚5。
2022年7月25日,浙江大学转化医学研究院/医学院附属邵逸夫医院谢安勇教授团队在Nature Communications杂志上发表了题为“DNA nicks induce mutational signatures associated with BRCA1 deficiency”的研究论文(Nat Commun 2022,13:4285),帮助回答了上述部分问题。该团队利用CRISPR/Cas9单链缺刻酶(nCas9)靶点滞留的特点,在细胞内定点高效诱导源于DNA单链缺刻的与DNA复制偶联的单末端DSB。这类DSB,而不是双末端DSB,在BRCA1缺陷细胞中诱导了更高频的染色体断裂、畸变与微核。随后,研究者利用一个可以区分、定量短轨基因转换(STGC)和长轨基因转换(LTGC)的 HR报告系统,分析BRCA1缺陷对单末端DSB的HR修复的影响。结果表明,BRCA1缺陷细胞中单末端DSB的HR修复效率下降,但LTGC偏向性却有所提升(图1)。特别是,BRCA1缺陷对LTGC偏向性的推动具有明显的DNA复制链的不对称性,即BRCA1缺陷更倾向于推动滞后链崩塌相关的LTGC的偏向性,这个结果与BRCA1缺陷肿瘤中突变模式的链不对称性可能有关联。

因为复制偶联单末端DSB也可以利用反向会聚复制叉产生的第二个单末端DSB进行NHEJ,研究者利用内源位点分析了这类NHEJ效率和接口序列,发现BRCA1缺陷细胞中InDel频率提高,特别是11-80bp的删除产物,并伴随微同源序列(Microhomology,MH)在接口的利用率的提高(图1)。这个现象与BRCA1突变肿瘤中InDel突变特征高度一致。相反,Cas9诱导的双末端DSB的NHEJ修复在BRCA1缺陷细胞中没有产生这类突变模式。因为BRCA1缺陷肿瘤中染色体易位频率提高,研究者也通过分析Cas9和nCas9诱导的染色体易位及BRCA1缺陷的影响,发现 Cas9诱导的染色体易位频率不因BRCA1缺陷而改变,但nCas9诱导的易位却因BRCA1缺陷从无到有,甚至大量发生。这说明BRCA1缺陷肿瘤中染色体易位是源于复制偶联的单末端DSB,而不是源于与复制无关的双末端DSB。
10Kb左右的TD是BRCA1缺陷肿瘤备受关注的特征性突变模式6。在这个研究中,双末端DSB诱导的TD水平并不受BRCA1缺陷的影响,而单末端DSB诱导的TD则在BRCA1缺陷细胞中显著富集(图1)。有趣的是,TD频率变化也具有明显的链不对称性,即BRCA1缺陷更倾向于推动滞后链崩塌相关的TD产生。根据TD产物的结构特征分析和推导,TD形成机制包括双轮链入侵(Two-Round Strand Invasion; TRIS)介导的和MH介导的TD形成(图1)。在BRCA1野生型细胞中,Cas9和nCas9都能诱导MH介导的TD产物,但只有nCas9诱导的这类TD才会在BRCA1缺陷细胞中频率提高,这与BRCA1缺陷肿瘤中积累相似的TD突变高度一致。
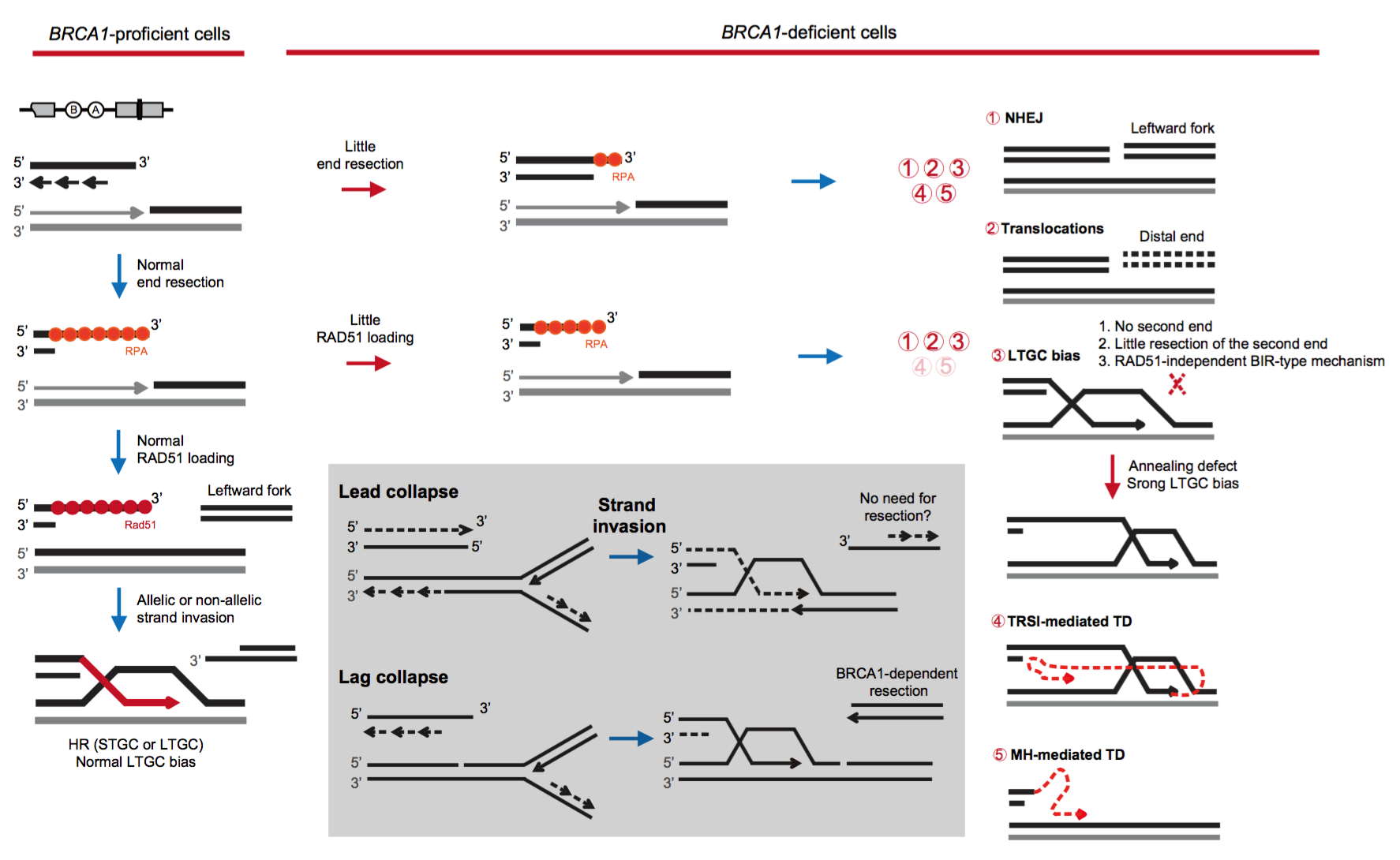
图1. 复制偶联单末端DSB修复异常诱导BRCA1缺陷肿瘤特征性突变模式机制示意
该研究不仅帮助阐明了BRCA1在双末端DSB和复制偶联单末端DSB修复中的功能差异,更重要的是,揭示了BRCA1缺陷肿瘤突变模式的一个主要诱因是复制偶联单末端DSB的产生及修复异常,而不是传统认为的双末端DSB。这将帮助推动肿瘤突变模式发生机制在肿瘤精准诊疗中的临床应用。同时也提醒,因为靶点滞留,在分裂细胞中,我们认为相对安全的CRISPR碱基编辑器和先导编辑器也会产生严重的染色体畸变7。
该论文通讯作者是浙江大学医学院附属邵逸夫医院和浙江大学转化医学研究院谢安勇教授和冯依力特聘研究员。冯依力和刘倩博士是本文第一作者。本课题得到了国家自然科学基金面上项目和浙江省自然科学基金项目的支持。谢安勇教授团队致力于肿瘤基因组不稳定性和CRISPR基因编辑技术机制与改良的研究,已先后在Mol Cell,Nat Struct Mol Biol,Nat Commun,Genome Biol,Nucleic Acids Res等一系列期刊发表学术论文。
论文链接:https://www.nature.com/articles/s41467-022-32011-x
参考文献:
1.Li, Y. et al. Patterns of somatic structural variation in human cancer genomes. Nature578, 112–121 (2020).
2.Chen, C.-C., Feng, W., Lim, P. X., Kass, E. M. & Jasin, M. Homology-directed repair and the role of BRCA1, BRCA2, and related proteins in genome integrity and cancer. Annu Rev Cancer Biol2, 313–336 (2018).
3.Davies, H. et al. HRDetect is a predictor of BRCA1 and BRCA2 deficiency based on mutational signatures. Nat. Med.23, 517–525 (2017).
4.Stok, C., Kok, Y. P., van den Tempel, N. & van Vugt, M. A. T. M. Shaping the BRCAness mutational landscape by alternative double-strand break repair, replication stress and mitotic aberrancies. Nucleic Acids Res49, 4239–4257 (2021).
5.Scully, R., Panday, A., Elango, R. & Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nat. Rev. Mol. Cell Biol.20, 698–714 (2019).
6.Menghi, F. et al. The tandem duplicator phenotype is a prevalent genome-wide cancer configuration driven by distinct gene mutations. Cancer Cell34, 197-210.e5 (2018).
7. Anzalone, A. V., Koblan, L. W. & Liu, D. R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nat. Biotechnol. 38, 824–844 (2020).


