浙江大学转化医学研究院周民团队在开发微藻药物递送系统平台技术方面取得系列进展
近日,浙江大学转化医学研究院/浙江大学医学院附属第二医院周民团队在开发了基于微藻新型药物递送系统的平台技术方面,取得了系列新进展。相关工作成果在高水平期刊《Nature Communications》、《Science Advances》和《Nano Today》连续发表学术论文,并受到《Nature Medicine》杂志评述论文中专门报道。
Nature Communications: 螺旋藻-氨磷汀复合药物用于保护肠道放疗保护
放疗是临床治疗中广泛使用的一种癌症治疗方法。在腹部/盆腔实体肿瘤(如胰腺癌、前列腺癌、结直肠癌等)的放射治疗中,经常会引起肠道损伤,可导致患者胃肠功能障碍甚至死亡,相关保护药物的研发仍然是临床上尚未满足的需求。
本研究工作中通过简单的脱水-复水策略将辐射防护药物氨磷汀负载到天然活性微藻钝顶螺旋藻中,制备了螺旋藻-氨磷汀口服给药系统。该药物在整个小肠具有全面的保护作用,明显优于游离药物和肠溶胶囊。可防止放疗引起的肠道损伤,延长生存期,且不影响肿瘤消退。此外,该系统可以保护肠道微生物群的稳定状态,避免氨磷汀的长期毒性。

该研究提出了一种基于微藻的系统,以克服氨磷汀口服给药对全肠道放射防护的挑战,从而提供一种有效的,具有临床应用潜力的口服放射防护剂,用于癌症放射治疗中的正常肠道保护。
论文链接:https://www.nature.com/articles/s41467-022-28744-4
Science Advances: 螺旋藻-姜黄素复合药物用于炎症性肠炎治疗
口服给药也面临如药物在胃酸环境中的降解,在肠道内滞留差,导致药物的口服利用度低等诸多挑战。当前,口服候选药物载体需要通过复杂的设计及合成过程,导致其面临了高技术挑战、高制造成本和低转化效率等问题。因此,开发一种简便、通用和生物相容性良好的口服给药策略具有重要意义。
本研究工作开发了一种新的口服给药策略,利用螺旋形的微藻负载药物姜黄素,并将药物输送至肠道组织,用于治疗结肠癌和结肠炎等多种肠道疾病。该螺旋藻载药系统可以在保持结构完整的状态下快速通过胃部,由于其螺旋形的结构特点,该螺旋状载药系统更易陷入在肠绒毛之间,逐渐降解并释放药物姜黄素,从而延长药物在肠道中的滞留时间及提高药物的吸收效率。该口服给药系统利用微藻载体的生物学特性能更有效地输送药物,提高药物的有效性,为肠道疾病治疗提供抗肿瘤和抗炎症的特性。
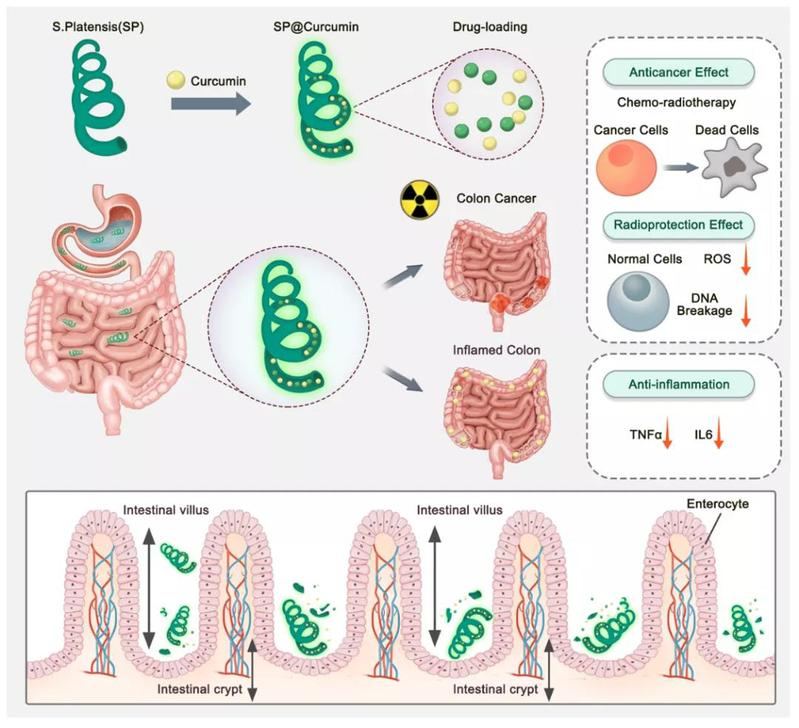
作为一种生物安全性好、质控可行性大、低成本可再生资源,以活性微藻来构建的微藻载药系统可以为肠道及相关疾病的创新性诊断和治疗开辟新的途径。
论文链接:https://www.science.org/doi/10.1126/sciadv.abi9265
Nano Today: 螺旋藻-小檗碱复合药物用于感染性伤口治疗
伤口难愈合是糖尿病患者常见并发症,常导致残疾。由于耐药菌株的出现、生物膜的形成以及伤口处局部缺氧,使得促进糖尿病患者感染伤口的愈合成为一个巨大的挑战。群体感应(quorum sensing, QS)是指微生物群体在其生长过程中,由于群体密度的增加,导致其生理和生化特性的变化,显示出少量菌体或单个菌体所不具备的特征如生物膜形成,耐药性出现等。因此,抑制细菌的QS系统可能会成为一种高效的非抗生素方法来治疗耐药菌感染的伤口。
本研究工作开发了小檗碱和螺旋藻被共同装载到水凝胶基质中以形成多功能生物活性水凝胶系统。该水凝胶在激光照射下可通过光动力效应快速产生大量活性氧并持续释放小檗碱,从而提高药物生物利用度并发挥小檗碱和ROS协同杀菌作用。水凝胶可以下调QS相关的基因和群体感应调控的毒力因子相关基因,从而影响耐药菌生物膜的形成并降低其毒力因子表达。水凝胶不但可以发挥高效杀菌作用,下调炎症因子的表达,而且在激光照射下释放的氧气可以减轻伤口局部缺氧环境,促进血管生成、细胞再生和迁移,最终加速伤口愈合。

本课题构建的水凝胶生物安全性高、成本低、合成简易快速,具有较大的临床转化潜力,是一种用来治疗糖尿病患者耐药菌感染性伤口的有效技术手段。
论文链接:https://doi.org/10.1016/j.nantod.2021.101368
周民团队近年来率先提出使用安全性高的微藻作为递送载体,解决大部分药物难以被高效输送到疾病部位的问题。通过新型生物材料实现更安全、高效的靶向性药物递送策略,可显著提高药物治疗效果,并具有较高临床转化和产业化可行性。该团队正在开展微藻药物的大动物模型药理和毒理学系统研究,推动其临床转化。
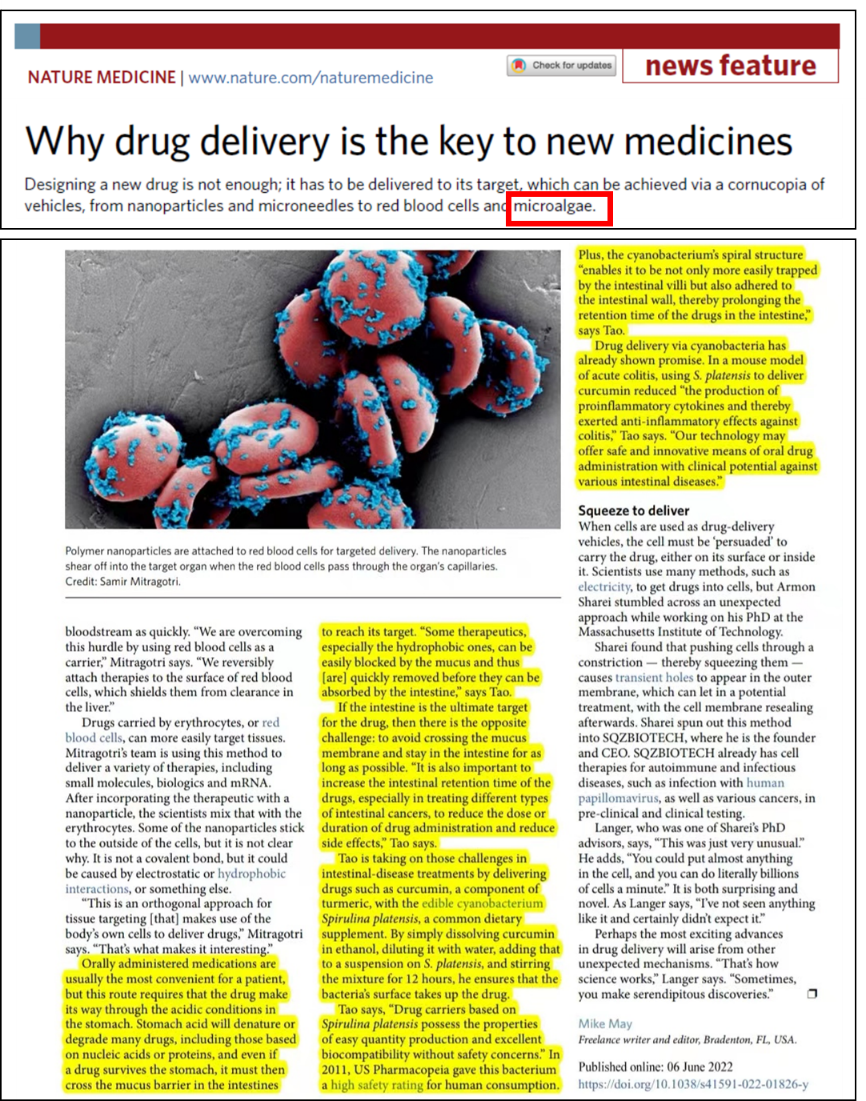
近期,Nature Medicine期刊撰写了关于药物递送系统重要性的一篇New Feature文章中,报道了药物递送系统在新时代医药中的关键作用。提出了“药物递送技术使得许多药物产品的开发成为可能,通过增强治疗药物靶向输送,最大限度地减少脱靶,从而改善患者健康”。该文章摘要中专门提到了两种新型药物递送载体,包括微藻载体。文中大篇幅报道了该团队关于微藻载药系统的相关工作。并指出微藻递送系统提供了一种安全、创新的平台技术,并具有较高的临床转化前景。
该系列相关研究得到了浙江大学交叉学科项目、国家重点研发计划、国家自然科学基金等项目的大力支持。周民研究员是浙江大学“百人计划”研究员,担任教育部恶性肿瘤预警与干预重点实验室副主任。自2016年回国以来,周民研究员及其带领的研究团队充分利用我校学科门类齐全、学科结构层次丰富、交叉学科平台集聚等学科生态多样化的优势。主要围绕“生物材料临床转化”国际研究热点、难点,致力于可转化新型生物材料的研发,通过与临床科室的紧密合作,取得了一系列创新性并具有较高临床转化前景的重要研究成果,并连续两年获得“浙江大学2017年度十大学术进展提名奖”及“浙江大学2017年度十大学术进展提名奖”。


