刘祥瑞/周天华课题组《Biomaterials》报道一种整合自噬抑制剂与基因毒素的纳米前药用于三阴性乳腺癌治疗研究
药物组合疗法常用于肿瘤临床治疗,但采取何种组合、何种比例、如何保证组合药物药代动力学行为和肿瘤组织分布的一致性是制约其疗效的主要问题。转移性三阴性乳腺癌(TNBC)预后差,患者生存期短。2020年,DNA拓扑异构酶I抑制剂7-乙基-10-羟基喜树碱(SN38)偶联的抗体药物偶联物已被美国FDA批准用于TNBC治疗。多种药物组合化疗策略已用于TNBC临床治疗,但现有联合化疗效果有限,毒副作用较大。
近日,浙江大学基础医学院刘祥瑞/周天华课题组在《Biomaterials》杂志在线发表了题为“Nanoprodrug ratiometrically integrating autophagy inhibitor and genotoxic agent for treatment of triple-negative breast cancer”的研究论文。该研究构建了协同机理明确、组合比例可调并具有肿瘤部位响应性释放能力的共组装纳米前药,可实现在肿瘤部位药物的精准协同递送。
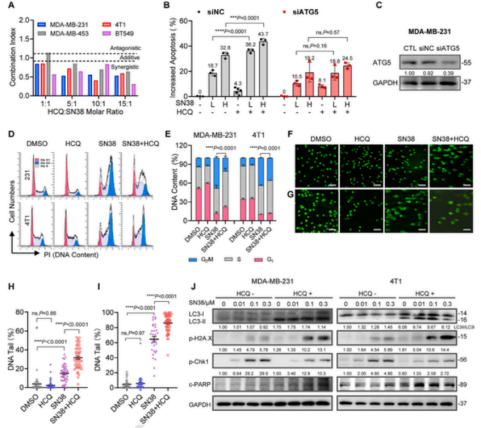
课题组研究发现在多种TNBC细胞系中自噬抑制剂羟氯喹(HCQ)能够显著增强SN38诱导的细胞凋亡,且不依赖于p53。进一步研究表明,HCQ可通过抑制自噬下调SN38诱导的chk1磷酸化,减少SN38导致的G2细胞周期停滞,阻止同源重组(HR)DNA修复过程,进而增加H2AX的磷酸化,增加SN38导致的DNA损伤。在摩尔比大于5:1的组合比例下,HCQ与SN38具有显著的协同效果。
在确定组合药物的协同比例后,研究人员根据HCQ和SN38分子结构疏水的特点,分别构建两亲性聚合物前药,通过聚合物混合共助装策略,构建了载药组合比例可调、体内外可按最佳协同比率递送组合药物的聚合物前药纳米联合递送平台(Combo NP)。通过二硫键的引入,赋予其肿瘤内还原响应释放的特性。
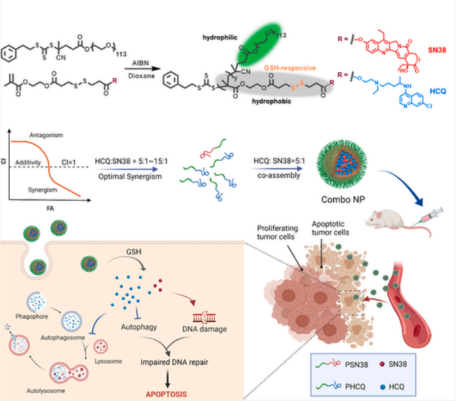
体内实验证明Combo NP不但能够在血液中实现HCQ与SN38按设定比例递送,而且可以实现在肿瘤中按设定比例蓄积。Combo NP与单一纳米颗粒以及小分子药物联合相比,在原位乳腺癌模型和肺转移模型中均展现出显著提高的抗肿瘤效果。
本研究为解决抗肿瘤联合治疗面临的问题和新一代纳米药物的设计提供了新的思路和范式。此外,研究团队针对胰腺癌及胃癌的协同治疗也取得了一些研究成果。论文发表于Biomaterials (https://doi.org/10.1016/j.biomaterials.2021.121176)和Journal of Nanobiotechnology (DOI:10.1186/s12951-021-01127-5)。
浙江大学基础医学院刘祥瑞副教授和周天华教授为本论文的共同通讯作者,浙江大学王惠芳博士为论文的第一作者。研究受国家自然科学基金资助,已申请发明专利“一种可精准调控联用药物比率的共递送纳米药物”(20210428510.9)。


