赵经纬课题组《Nature Communications》揭示β-NMN延缓髓鞘老化并增强髓鞘修复的新机制
然而,在衰老过程中髓鞘会出现特征性的结构变化,即髓鞘老化(myelin aging),是CNS衰老的重要驱动力。OL胞体或者髓鞘受损引起的髓鞘变性并脱离轴突,称为脱髓鞘(demyelination);而广泛分布于CNS内的成年神经干细胞之一——少突胶质细胞前体细胞(oligodendrocyte progenitor cell, OPC)可以分化发育为成熟的OL,形成新的髓鞘包裹轴突,这一再生过程称为复髓鞘(remyelination)。
Sirtuins是高度保守的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)依赖的去乙酰化酶,哺乳动物的sirtuin家族有7个亚型(SIRT1-SIRT7)。赵经纬团队发现只有SIRT2特异性地在OL谱系中高表达。目前鲜有关于SIRT2在髓鞘发育或者髓鞘再生过程中的研究,且仅有的研究结果还存在争议,具体分子机制仍不清楚。
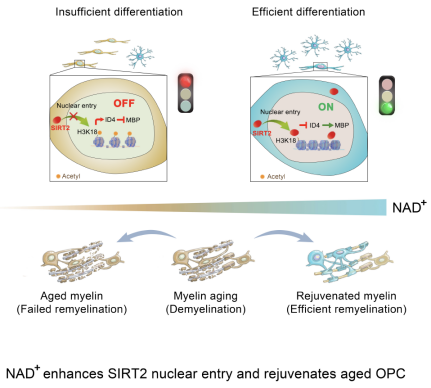
该论文采用端粒酶功能障碍早衰小鼠、SIRT2全身敲除和条件敲除小鼠,综合多种研究手段,发现了补充NAD+的直接前体β-烟酰胺单核苷酸(β-NMN),可以促进老年OPC中SIRT2的表达和入核,进而增强老年OPC的分化和延缓髓鞘老化,以及促进髓鞘损伤后的修复。该研究深入揭示了NAD+的靶向分子、入核机制及表观遗传机制。
为进一步探究SIRT2与髓鞘修复之间的关系,研究人员使用SIRT2CreERT; SIRT2少突胶质细胞是高度耗能的细胞,然而OPC的代谢组学随着衰老进程如何变化尚不清楚。研究人员纯化分离了早衰小鼠(G3 Terc-/-)的OPC,采用代谢质谱技术检测到衰老OPC中NAD+含量显著下降。补充β-NMN使SIRT2的表达上调并提高了衰老OPC的分化能力。在体实验中,作者在早衰小鼠和自然衰老小鼠的胼胝体中均发现了髓鞘老化和髓鞘修复效率降低现象。而补充β-NMN使SIRT2在OPC中的表达和核定位均增加,并在结构上可以改善髓鞘质量,延缓髓鞘老化并增强髓鞘修复;在功能上,作者通过电生理检测到补充β-NMN可以促进胼胝体复髓鞘区轴突对动作电位的传导。
该论文揭示了补充β-NMN可以提高老年OPC中SIRT2的表达和入核,从而促进老年OPC的分化、延缓髓鞘老化并促进髓鞘损伤后的修复。为预防中枢神经系统髓鞘老化和脱髓鞘疾病治疗提供了新的分子靶点和候选药物。
<p font-size:17px;background-color:#ffffff;vertical-align:inherit;text-indent:2em;= style=margin-top: 0px; margin-bottom: 0px; padding: 0px; font-size: 16px; font-family: microsoft yahei !important; line-height: 32px !important;>浙江大学基础医学院赵经纬教授为论文的最后通讯作者, 暨南大学衰老与再生医学研究院鞠振宇教授、复旦大学脑科学转化研究院舒友生教授及中国医学科学院北京协和医学院陈厚早教授为共同通讯作者。浙江大学基础医学院博士生马晓茹和杭州师范大学基础医学院朱栩栋教授为本文共同第一作者。本研究受到国家科技部重点研发计划(2017YFA0104900,2021ZD0201700,BZZ19J005和2021ZD0202501)、国家自然科学基金委员会(81971144,81571170,92049304和82030039)以及中国医学科学院医学科学创新基金(2021-I2M-1-050)的资助。