转化医学研究院周民/哈佛陶伟开发口服螺旋藻药物递送策略用于肠道疾病治疗
由于患者依从性及生物安全性高,给药方式方便,口服给药仍然是治疗胃肠道疾病首选和最常用的给药途径。然而,口服给药也面临如药物在胃酸环境中的降解,在肠道内滞留差,导致药物的口服利用度低等诸多挑战。为提高口服效率,各种药物载体如脂质体、树枝状大分子、胶束、聚合物纳米粒子、金属和磁性纳米颗粒等被广泛应用于口服药物递送系统的设计。然而,这些候选药物载体需要通过复杂的设计及合成过程,来优化它们的物理化学特性,从而允许应用于药物递送及口服治疗。同时这也面临了高技术挑战、高制造成本和低转化效率等问题。更重要的是,将这些化学合成材料转化为临床应用的可行性受到低生物相容性、降解性和体内毒性等的严重限制。因此,开发一种简便、通用和生物相容性良好的口服给药策略具有重要意义。
近日,浙江大学转化医学研究院/浙江大学医学院附属第二医院周民教授团队联合哈佛大学医学院陶伟教授团队,在活性微藻药物递送系统的生物医学应用上取得新进展,在Science Advances发表题为Orally Deliverable Strategy Based on Microalgal Biomass for Intestinal Diseases Treatment 的研究论文。该研究工作开发了一种新的口服给药策略,利用螺旋形的微藻负载药物姜黄素,并将药物输送至肠道组织,用于治疗结肠癌和结肠炎等多种肠道疾病。该口服给药系统利用微藻载体的生物学特性能更有效地输送药物,提高药物的有效性,为肠道疾病治疗提供抗肿瘤和抗炎症的特性。该文被期刊编辑部选为Cover 封面论文。

该螺旋藻载药系统可以在保持结构完整的状态下快速通过胃部,由于其螺旋形的结构特点,相比球形载体,该螺旋状载药系统更易陷入在肠绒毛之间,逐渐降解并释放药物姜黄素,从而延长药物在肠道中的滞留时间及提高药物的吸收效率,同时不引起不良反应。在结肠癌的传统放疗中,该螺旋藻载药系统表现出化疗与放疗联合抑制肿瘤的协同治疗效果。同时,在放疗过程中能作为辐射保护剂,通过消除正常细胞中由高剂量X射线照射引起的活性氧ROS生成,减少ROS诱导的细胞DNA损伤来保护正常肠道组织。除在癌症治疗中的应用外,本研究工作还发现了该口服策略在结肠炎治疗中的应用潜力,该螺旋藻载药系统有效降低了DSS诱导的结肠炎小鼠的促炎细胞因子水平,减轻了炎症相关症状,对结肠炎具有良好的抗炎作用。
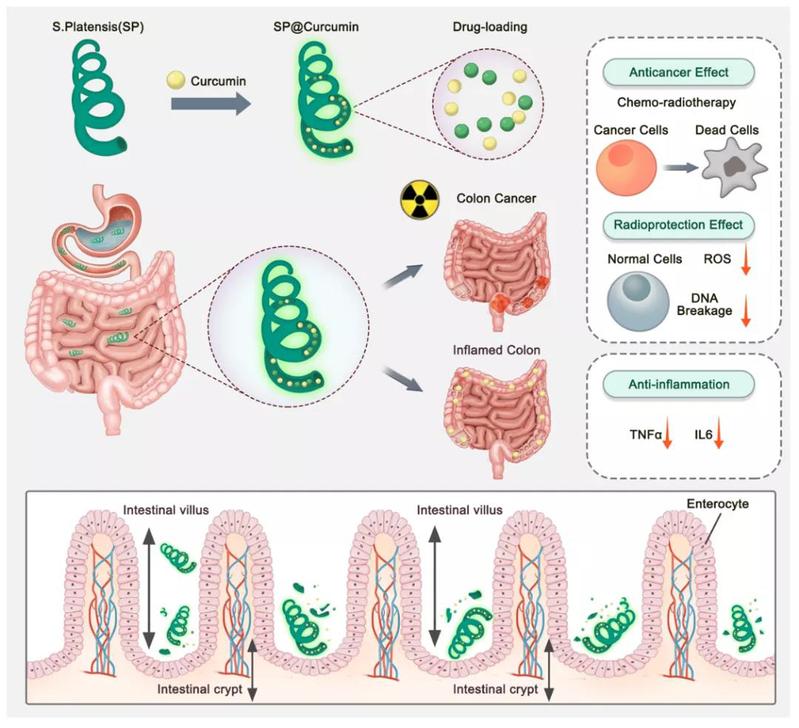
图1 载姜黄素螺旋藻介导的结肠癌放化疗联合治疗及对肠道炎症的抗炎作用示意图
克服人体多种生理屏障,提高药物利用度是当前口服药物领域所面临的巨大挑战。同时,研发低成本、高生物安全性、高递送效率的药物递送体系也是解决其临床转化的主要瓶颈。作为一种生物安全性好、质控可行性大、低成本可再生资源,以活性微藻来构建的微藻载药系统可以为肠道及相关疾病的创新性诊断和治疗开辟新的途径。
浙江大学转化医学研究院周民团队博士生钟丹妮、浙江大学转化医学研究院周民团队博士生张东晓和哈佛大学医学院陈纬博士是论文的共同第一作者,浙江大学医学院附属第二医院/转化医学研究院周民研究员和哈佛大学医学院陶伟教授为论文的共同通讯作者。
原文链接:
https://www.science.org/doi/10.1126/sciadv.abi9265


