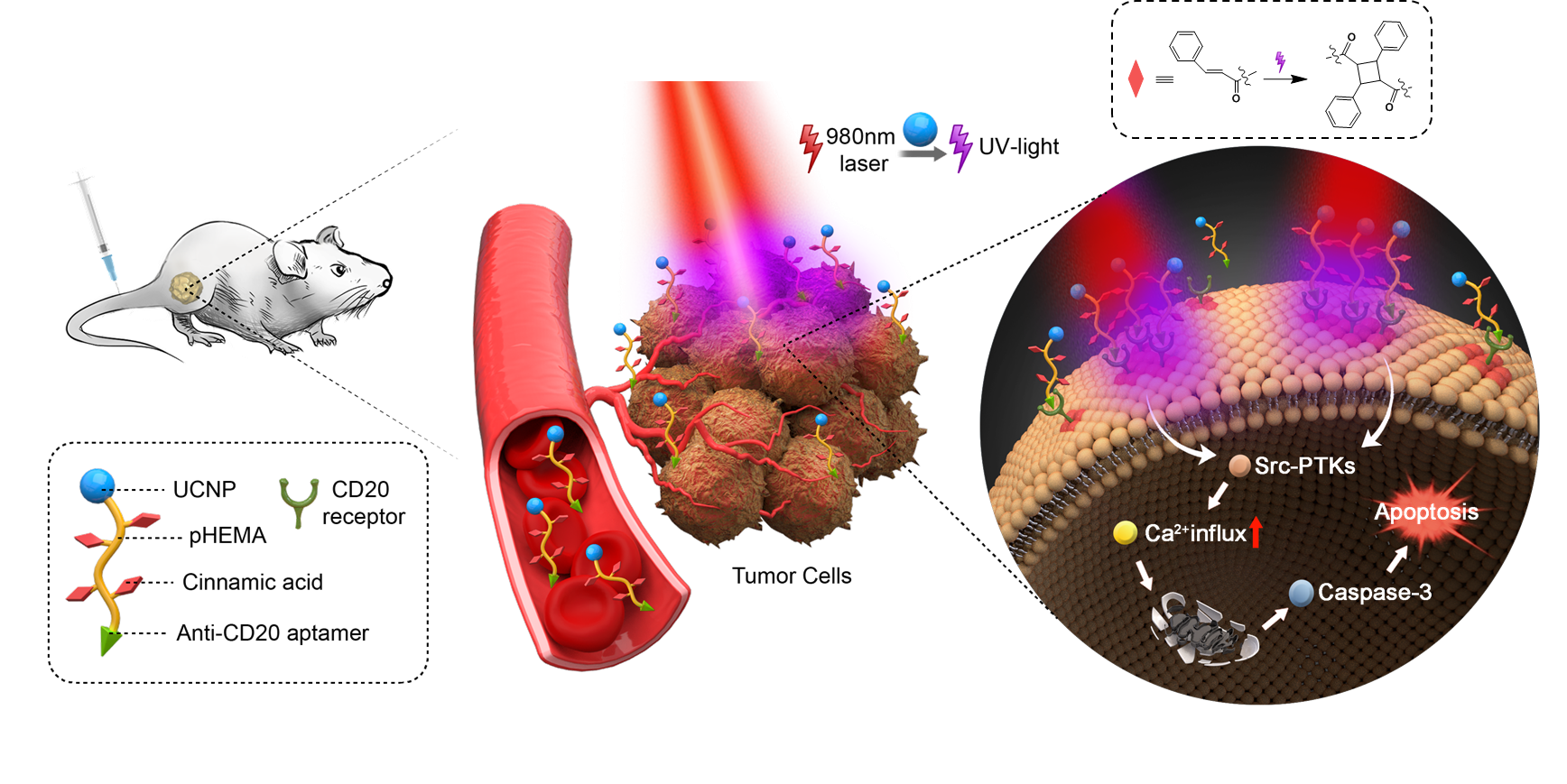
药学院杜永忠课题组在Nano Today报道一种光控“无药物”大分子的肿瘤治疗新策略
2021年12月23日,浙江大学药学院杜永忠教授课题组在Nano Today在线发表题为“Spatiotemporally light controlled “drug-free” macromolecules via upconversion-nanoparticle for precise tumor therapy”的研究论文。论文报道了一种在适配体介导下实现肿瘤部位高度积累并精准定位于肿瘤细胞膜表面受体的 “无药物”大分子,在局部近红外光照下可将近红外光转换为紫外光,实现肿瘤细胞膜受体的交联,进而激活细胞内凋亡信号通路,诱导细胞发生凋亡,发挥抗肿瘤效果,为肿瘤的安全高效精准靶向治疗提供了一种新策略。

肿瘤的靶向治疗是改善药物体内分布、提高疗效、降低毒副反应的有效方式。但是通过对已成功上市的制剂研究发现,肿瘤化疗药物的靶向治疗虽然改变了药物的体内分布,但临床疗效改变并不显著。其主要原因在于:1)制剂的肿瘤组织、细胞的靶向效率并未达到预期目标,脱靶化疗药物的毒副作用仍然无法有效避免,导致应用剂量受限,无法根除肿瘤;2)制剂到达靶点之后药物从载体材料中的释放过于缓慢。针对制剂到达靶点之后药物从载体材料中的释放问题,课题组设计了全球第一个具有上临界溶解温度的聚合物胶束材料,用于化疗和免疫抑制剂的靶向递送,实现肿瘤安全高效的化学治疗(Angew Chem Int Edit 2015; Biomaterials 2017; Nano Research 2021)、免疫治疗(Nano Letters 2019),以及化疗与免疫的协同治疗(Nature Communications 2021)。
在课题组前期细胞膜表面受体交联诱导肿瘤细胞凋亡的工作基础(Chemical Science, 2020)上,针对化疗药物靶向制剂脱靶的问题,本研究设计了一种由上转换纳米粒、适配体、水溶性聚合物和肉桂酸构成的光控“无药物”大分子。该大分子首先在适配体的介导下实现肿瘤部位的高度积累,并精准定位于肿瘤细胞膜表面受体。随后在肿瘤局部应用组织穿透性良好的近红外光照射,其中的上转换纳米粒可将近红外光转换成紫外光,诱导聚合物上的肉桂酸发生光二聚反应,促使聚合物在细胞表面的交联,进而引起细胞膜受体的交联和聚集,触发细胞内的凋亡信号通路,诱导细胞发生凋亡;而无光照部位和条件下,不会出现细胞凋亡问题,因此该技术策略实现了肿瘤的安全高效精准治疗,并通过肿瘤模型动物的原位注射和静脉注射给药方式予以证实。本研究设计的光控“无药物”大分子,无小分子化疗药参与,为肿瘤的安全高效精准治疗提供了新思路、新手段,也为受体交联和聚集调控细胞命运的研究提供了一种新策略。
本课题受到浙江省自然科学基金重大项目、国家重点研发计划“政府间国际科技创新合作”项目、国家自然科学基金项目和江苏省自然科学基金的支持。本文第一作者为浙江大学药学院2018级博士生王君和2016级博士生祁菁,通讯作者为浙江大学药学院杜永忠教授和徐晓玲博士、浙江大学丽水医院纪建松教授和南京理工大学李伟硕副教授。
原文链接:
https://www.sciencedirect.com/science/article/pii/S1748013221002851


