转化院梁平实验室:应用诱导多能干细胞衍生的心肌细胞模型发现MYBPC3相关肥厚性心肌病的新机制
肥厚型心肌病 (hypertrophic cardiomyopathy, HCM) 是遗传性心脏病的最常见形式,在人群中的发病率大概在1:500到1:200之间。HCM的特征是各种形态的左心室肥厚,伴有一系列临床表现和血流动力学异常。HCM相关症状可以分为心力衰竭、胸痛和心律失常,而HCM导致的恶性心律失常是青少年和运动性人群猝死的最主要原因。到目前为止,已知的HCM相关基因不下11种,相关突变更是超过1500个。其中,编码肌球蛋白结合蛋白C的MYBPC3基因是最常见的HCM相关基因,而且90%以上的MYBPC3基因突变为无义突变(non-sense mutation),导致其出现提前终止 (premature termination codon, PTC)。然而,MYBPC3相关HCM的确切机制仍有待解决。
2021年12月30 日,浙江大学转化医学研究院/浙江大学医学院附属第一医院梁平团队与浙江大学医学院附属邵逸夫医院蒋晨阳团队合作在Clinical and Translational Medicine杂志在线发表Inhibition of HSC70 alleviates hypertrophic cardiomyopathy pathologyin human induced pluripotent stem cell derivedcardiomyocytes with a MYBPC3mutation的研究论文。该研究发现了MYBPC3相关肥厚性心肌病(MYBPC3-related HCM)的新机制以及潜在治疗靶点。
研究团队对大批的临床HCM先证者及家属开展了全外显子测序,筛查致病基因。在这个队列中,研究者发现有4个不同家系携带了同一个MYBPC3基因的缺失突变(c.1377del; p.Leu460fs)。这四个家系的先证者都存在典型的HCM症状和影像学特征。尤其是4号先证者,入组前经历过一次致死性心律失常事件,随后接受了植入型心律转复除颤器(ICD)植入和射频消融治疗。为了探究这一突变的致病性及其分子机制,团队开展了后续研究。

图1. 病人临床特征
研究者对健康志愿者皮肤活检后进行成纤维细胞的培养和扩增,并应用非整合型仙台病毒进行体细胞重编程建立诱导多能干细胞(iPSCs),并应用心肌定向分化技术获得iPSC衍生的心肌细胞(iPSC-CMs)。后续,研究者构建了携带有与病人相同点突变的MYBPC3质粒。通过慢病毒过表达的方法在正常人iPSC-CMs中导入了野生型(WT)和突变型(MUT)的人源MYBPC3质粒。在免疫荧光、qPCR、Western blot和钙成像等实验中发现:在血管紧张素II(angiotensin II, Ang II)诱导下,与野生组相比,突变组心肌细胞表现出细胞面积增大、肥大标志物表达上升、MYBPC3蛋白水平下降、心律失常以及细胞内钙超载(Ca2+ overload)等HCM的细胞表型。进一步的丁卡因实验发现:兰尼碱受体2(RYR2)介导的钙漏(RYR2-mediated Ca2+ leak)增加导致了突变组心肌细胞内的钙超载。
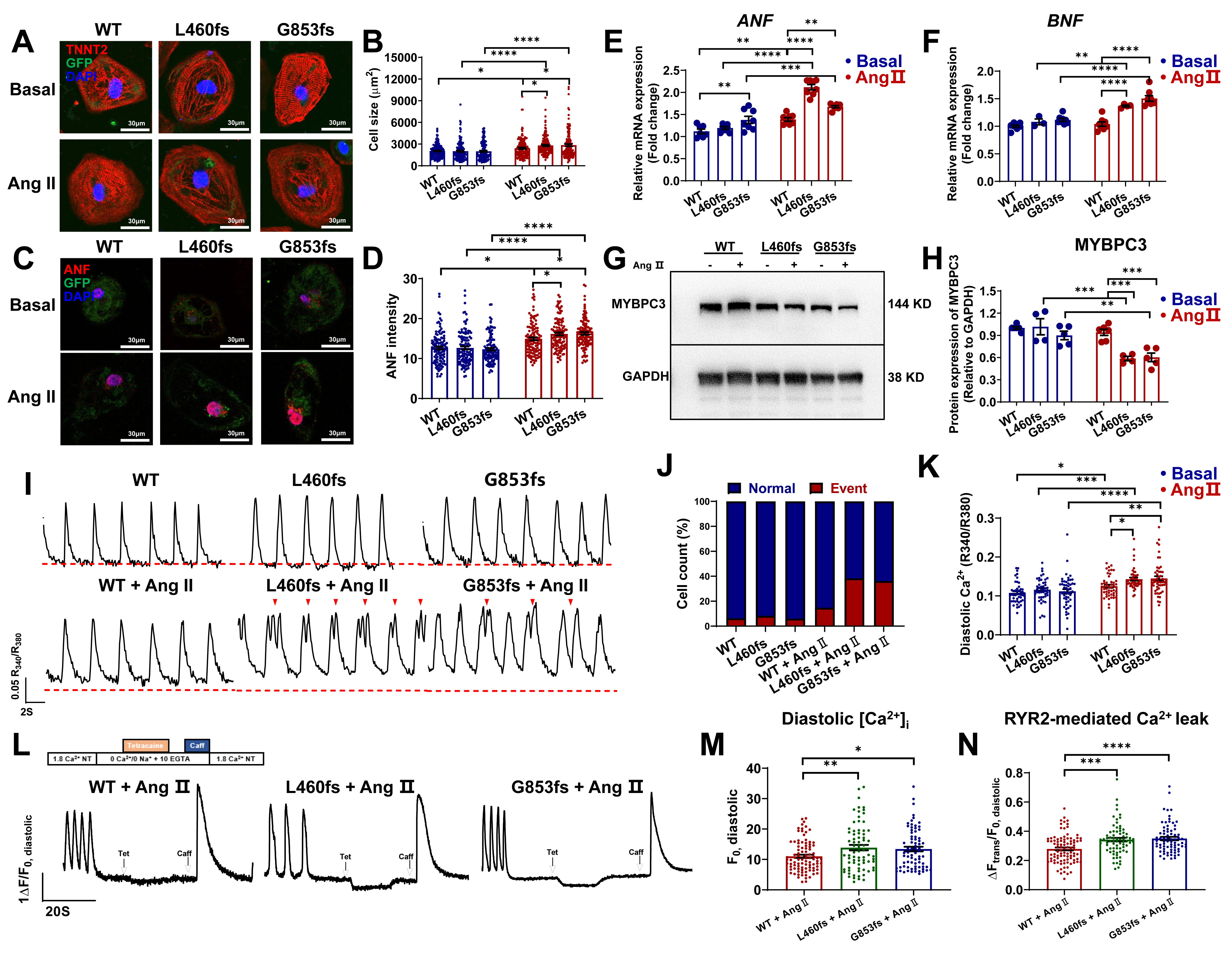
图2. AngII诱导下野生组和突变组心肌细胞的功能学表型分析
后续,为了探究MYBPC3突变导致HCM的分子机制,研究者对Ang II处理的野生组和突变组心肌细胞进行了转录组测序。数据分析显示:差异表达基因富集在心肌收缩、心肌肥大等信号通路;我们也关注到了HSPA8及其编码蛋白HSC70在Ang II处理的突变组心肌细胞中显著上调。既往研究中报道过HSC70与MYBPC3存在共定位,同时参与MYBPC3的蛋白降解。为了进一步明晰HSC70 在MYBPC3突变相关HCM中的作用,研究者应用HSC70特异性抑制剂(VER-155008)和激活剂(YM-1)分别处理野生组和突变组心肌细胞,实验结果发现:VER-155008能够挽救突变组心肌细胞中由Ang II诱导引起的肥大表型,同时MYBPC3蛋白水平也得到显著恢复;而YM-1可以在基线条件下诱导突变组心肌细胞出现肥大表型,同时引起MYBPC3蛋白表达显著下调。此外,在HSC70抑制剂VER-155008作用下,突变组心肌细胞中RYR2介导的钙漏也显著下调,使得细胞内钙超载显著减轻。
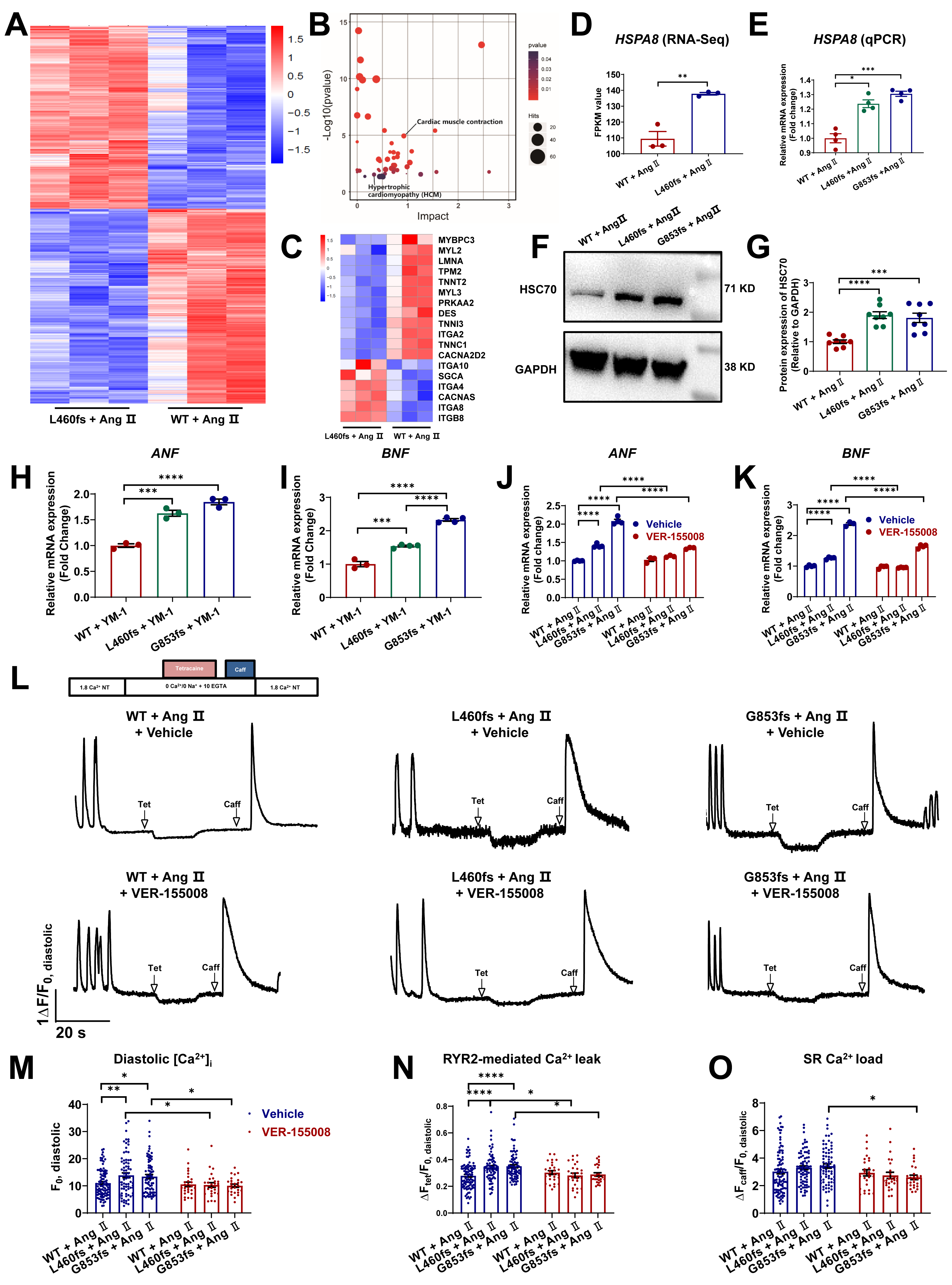
图3. 抑制HSC70能够挽救突变组心肌细胞的肥大表型
在进一步的机制分析中,研究者发现使用HSC70激动剂和抑制剂都能调控MYBPC3的蛋白水平,而使用氯喹抑制溶酶体功能后明显抑制了MYBPC3的蛋白降解。这一结果提示:HSC70主要通过溶酶体途径参与了MYBPC3的蛋白降解过程。

图4.HSC70通过溶酶体途径参与MYBPC3的蛋白降解
这项研究证实了临床筛查中发现的MYBPC3基因突变(c.1377del; p.Leu460fs)可导致HCM的发生,为该新发突变的致病性提供了扎实的功能学依据。我们发现了MYBPC3作为心肌结构蛋白调节心肌收缩的同时也参与RYR2相关的钙稳态调控,而HSC70通过调控MYBPC3的蛋白周转在HCM发生中发挥关键作用。我们的研究提示了HSC70可以作为MYBPC3相关HCM的潜在治疗靶点。
浙江大学医学院附属邵逸夫医院博士生裘航远为论文的第一作者,浙江大学转化医学研究院/浙江大学医学院附属第一医院梁平教授、浙江大学医学院附属邵逸夫医院蒋晨阳教授为论文的通讯作者。同时,这项研究获得了浙江大学医学院附属邵逸夫医院傅国胜教授、杭州市妇产科医院王昊副主任医师以及浙江大学医学院附属邵逸夫医院孙雅逊副主任医师的大力支持。


