转化院梁平实验室:应用人诱导多能干细胞衍生的心肌细胞模型揭示阿奇霉素致心脏毒性的分子机制
阿奇霉素 (Azithromycin,AZM) 是第二代大环内酯类抗生素,抗菌谱广,应用非常广泛,但已有研究提示该药有潜在的致死性心律失常和心血管死亡风险。2009年,美国食品药品监督管理局(FDA)报告了至少20例阿奇霉素相关的尖端扭转性室速。然而,在其它回顾性研究中,关于阿奇霉素致心血管风险的结果尚无明确定论:2012年,新英格兰医学杂志报道了5天治疗期内,与不使用抗生素组相比,阿奇霉素使用组的全因死亡、心血管死亡和心脏性猝死风险均明显升高;随后,2013年刊登在新英格兰医学杂志的另一项研究却并未发现阿奇霉素与心血管死亡风险的增加相关,该研究表明,阿奇霉素服用组死亡风险的增加很可能与病人的急性感染有关。目前,阿奇霉素有无心血管风险尚无定论,作用机制并不清楚。
2021年9月16日,浙江大学转化医学研究院/浙江大学医学院附属第一医院梁平教授团队在Clinical and Translational Medicine 杂志上在线发表题为Characterization of the molecular mechanisms underlying azithromycin-induced cardiotoxicity using human induced pluripotent stem cell-derived cardiomyocytes的研究论文。该研究揭示了阿奇霉素导致心脏毒性的分子机制。
首先,作者应用诱导多能干细胞衍生的心肌细胞(iPSC-CM)模型进行了阿奇霉素急性给药的电生理研究。微电极阵列实验显示:低浓度阿奇霉素对iPSC-CMs的场电位(field potential,FP)无显著影响;而高浓度阿奇霉素作用下,iPSC-CMs的心率显著加快,场电位时程(FPD)显著缩短。作者进一步应用单细胞膜片钳评价阿奇霉素对不同离子电流的影响,发现了高浓度阿奇霉素能够显著抑制钠通道和钙通道电流,而对于钾通道特别是以往认为的潜在作用靶点hERG钾通道几乎没有影响。
接下来,作者进行了阿奇霉素慢性给药的电生理研究。与急性作用的实验结果相似,作者发现了高浓度阿奇霉素慢性给药能够引起iPSC-CMs的心率显著加快和FPD显著缩短。对于离子电流的研究表明:高浓度阿奇霉素慢性给药显著抑制钙通道电流,而对于钠通道和钾通道影响不大。

图1. 阿奇霉素慢性给药对于iPSC-CMs的电生理影响
在慢性给药过程中,阿奇霉素处理后的iPSC-CMs出现明显的形态学变化并产生大量空泡,由于此前文献报道阿奇霉素倾向于在酸性细胞器中累积,因此这一变化促使作者进一步探究阿奇霉素对心肌细胞内溶酶体及自噬过程的可能影响。后续实验中,Lysotracker染色指示阿奇霉素处理的iPSC-CMs中的溶酶体呈肿胀形态,而质粒转染(mCherry-GFP-LC3)以及LC3,p62等自噬相关蛋白的Western blot实验均表明阿奇霉素干扰了iPSC-CMs中的自噬体成熟。随后,通过添加相关药物对自噬进行激活(Torin)/抑制(ULK1抑制剂MRT68921)可以发现,阿奇霉素诱导下,在上游激活自噬会加重自噬体增多、细胞活性降低等表型,而在上游抑制自噬则可以减少累积的自噬体数量并使细胞活性得到恢复,但这些药物并不能改善溶酶体异常。有趣的是,对细胞进行撤药处理可以有效改善溶酶体的异常表型并使细胞活性得到恢复。
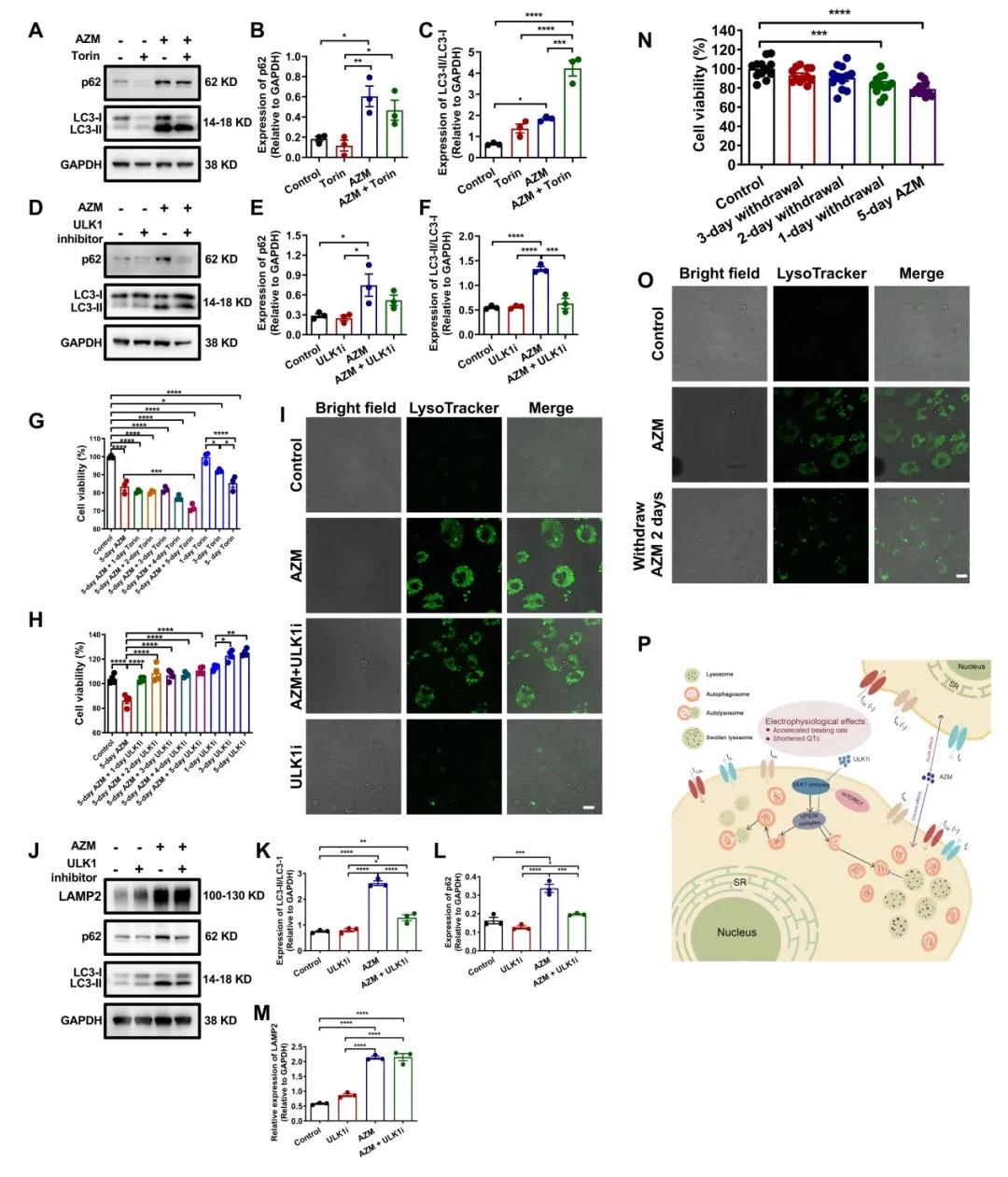
图2. 抑制早期自噬或撤药能够有效逆转阿奇霉素引起的心脏毒性
总的来说,低浓度阿奇霉素在电生理学和形态学上均无心脏毒性。而高浓度阿奇霉素能够通过急性抑制钠通道和钙通道、或慢性抑制钙通道,引起健康对照人群出现心率加快,QT间期缩短,但无心律失常风险。形态学上,高浓度阿奇霉素会干扰溶酶体活性,影响自噬体成熟,引起自噬体在下游累积,进而导致空泡形成、肌节损伤和心肌细胞死亡;而ULK1抑制剂可以通过抑制早期自噬减轻自噬体累积的负担并挽救部分有害表型。由于阿奇霉素在健康对照人群中没有致心律失常风险,因此我们的研究结果提示,在必要时可以开具阿奇霉素处方,但对于存在并发症的高危患者应谨慎考虑。
浙江大学转化医学研究院科研助理王晓晨和浙江大学转化医学研究院博士生潘紫薇为论文的共同第一作者,浙江大学医学院附属第一医院及浙江大学转化医学研究院梁平教授和浙江大学转化医学研究院冯晔教授为论文的通讯作者。同时,这项研究获得了浙江大学基础医学院孙启明教授的大力支持。


