转化医学研究院周民团队ACS Nano:溶葡球菌酶微球实现耐药细菌肺炎的靶向治疗和预防
感染性肺炎是发病率和死亡率较高的一种疾病,近几年,金黄色葡萄球菌已经成为主要的病原体。耐甲氧西林金黄色葡萄球菌(MRSA)的出现更是加剧了肺炎治疗的困境。MRSA感染导致的死亡率明显高于敏感菌株引起的肺炎。研究显示菌株的高毒力和高致病性可能是导致MRSA感染难治的因素。除了产生特定的毒素外,MRSA感染还会形成生物膜,是细菌的另一重要的毒力因子。一旦形成生物膜,细菌包埋在自身产生的细胞外基质中,提高了对外界抗菌物质和宿主免疫系统的抵抗,增加了清除的难度。因此,急需一种集抗菌、抗毒力的多功能手段治疗和预防MRSA肺炎。
溶葡萄球菌酶(lysostaphin)是一种内生肽酶,能特异性酶切葡萄球菌细胞壁中的交联多甘氨酸桥,在体内及体外显示出对葡萄球菌包括MRSA菌株的杀菌能力,同时也可以有效的破坏生物膜,是一种非常有潜力的抗菌药物。目前溶葡球菌酶已被成功研究报道用于骨骼感染,角膜炎,皮肤感染等疾病模型,但是不同于角膜,皮肤等相对较为浅表的器官,处于深部的肺脏器,通过静脉途径给药后,溶葡球菌酶在肺内的有效浓度较低,难以达到治疗效果。针对以上问题,近期,浙江大学转化医学研究院周民研究员课题组、新加坡国立大学陈小元教授课题组和浙江大学医学院附属第二医院徐峰教授课题组联合在国际知名期刊ACS Nano上发表文章“Lung Targeting Lysostaphin Microspheres for Methicillin-Resistant Staphylococcus aureus Pneumonia Treatment and Prevention”(IF:15.881)。
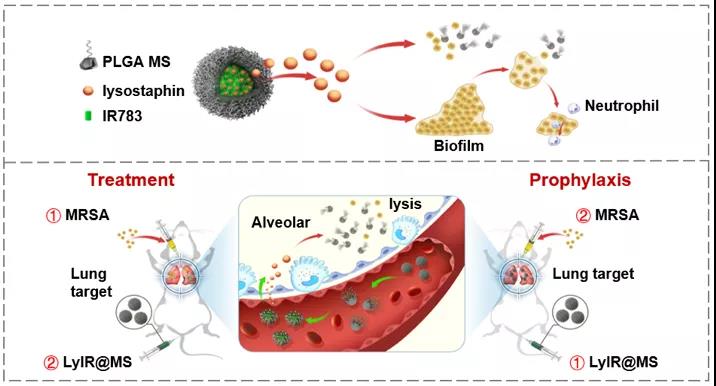
本研究设计了具有良好生物相容性和可降解性的羟基乙酸共聚物(PLGA)载药微球,用于实现肺部靶向递送溶葡球菌酶改善MRSA肺炎预后。研究结果显示该体系(LyIR@MS)在体外有较强的抗游离MRSA和抗生物膜的能力,可以有效降低MRSA毒力因子的表达,提高生物膜对宿主中性粒细胞的敏感性。在MRSA肺炎小鼠模型中,治疗性或者预防性尾静脉注射LyIR@MS可以有效的聚集到肺部,在感染部位持续释放溶葡球菌酶,提高小鼠生存率,减少肺内细菌负荷,降低肺部炎症损伤,预防生物膜形成进而演变成为慢性感染。本课题研究结果显示,设计的LyIR@MS具有较大的临床转化潜力,是一种用来靶向治疗和预防MRSA肺炎的有效技术手段。
浙江大学医学院附属第二医院博士生林秀慧,浙江大学浙江大学医学院附属第二医院/转化医学研究院博士生何健为该论文的第一和共同第一作者。浙江大学周民研究员、新加坡国立大学陈小元教授、浙二医院徐峰教授为论文的共同通讯作者。上述研究得到了国家自然科学基金、浙江省重点研发计划项目基金、现代光学仪器国家重点实验室等基金项目的大力支持。
周民团队近年来在细菌感染性疾病诊断和治疗领域持续开展工作,发表了一系列相关研究论文(ACS Nano 2020, Biomaterials 2020, Bioact. Mater. 2021, Theronostics 2020, ACS Appl. Mater. Interfaces 2019, ACS Appl. Mater. Interfaces 2018)。其中自主研发的眼用凝胶项目已获得临床伦理批准,正在开展临床试验。
论文链接:
https://pubs.acs.org/doi/10.1021/acsnano.1c06460


