浙江大学药学院杜永忠教授课题组在Journal of Controlled Release发布肿瘤光动力联合免疫治疗研究新进展
2021年7月16日,浙江大学药学院杜永忠教授和浙江大学丽水医院纪建松教授团队在Journal of Controlled Release在线发表了题为“Cancer-cell-biomimetic Upconversion nanoparticles combining chemo-photodynamic therapy and CD73 blockade for metastatic triple-negative breast cancer”的研究论文,首次报道了利用癌细胞膜修饰的上转换纳米粒共载光敏剂与化疗药物实现对三阴性乳腺癌的深层光动力联合化疗的治疗研究。同时,通过联用胞外核苷酶CD73抗体进一步放大肿瘤免疫原性细胞死亡引起的免疫反应,从而达到抑制肿瘤远端转移的治疗效果。该研究有望为三阴性乳腺癌的临床治疗策略提供新思路与新方法。

乳腺癌是乳腺上皮细胞在多种致癌因子的作用下发生增殖失控导致的疾病,为女性最常见的恶性肿瘤。三阴性乳腺癌(Triple-Negative Breast Cancer, TNBC)是一种特殊亚型的乳腺癌,特指3种受体均为阴性的乳腺癌,包括雌激素受体(Estrogen Receptor,ER)、孕激素受体(Progesterone Receptor,PR)及表皮生长因子受体2(HER-2),发病率约占所有乳腺癌的15%。与其他乳腺癌亚型相比,三阴性乳腺癌具有侵袭性高、转移早、复发率高、预后差等特点,且绝大多数死亡发生于治疗后的第1个5年内。目前临床上治疗三阴性乳腺癌主要有手术、放疗和化疗三种方案,但这些治疗手段存在术后易转移,治疗效果有限,全身毒副作用大等缺点。因此,开发一种安全高效的三阴性乳腺癌精准疗法迫在眉睫。
杜永忠教授和纪建松教授近年来致力于开发针对不同肿瘤诊疗的新型药物递送系统,并特别关注微波热疗、光动力治疗、免疫疗法等新型治疗手段与传统化疗、介入治疗等的联合治疗研究。课题组近年来在Nat Commun,Nano Lett,Angew Chem Int Edit,ACS Nano,Biomaterials, Theranostics,J Control Rel,ACS Appl,Materials等国际知名期刊发表多项原创性工作,受到国内外学者的广泛关注。本项研究在前期工作的基础上,设计并制备了一种癌细胞膜修饰的共载阿霉素与光敏剂的上转换纳米粒,静脉注射后可,纳米粒可逃避网状内皮系统捕获并靶向蓄积在肿瘤组织内部。
研究结果证明,该仿生纳米递药系统在静脉给药并辅以体外近红外光照射后,可在深层肿瘤组织中产生大量细胞毒性活性氧并引起阿霉素的响应性释放,达到光动力协同化疗的抗肿瘤疗效。光动力协同化疗在直接杀伤癌细胞的同时还会诱导肿瘤免疫原性细胞死亡,激活机体的抗肿瘤免疫反应。而CD73抗体可有效抑制腺苷通路引起的肿瘤微环境免疫抑制,进一步放大肿瘤特异性免疫反应,实现光动力治疗、化疗和免疫治疗的协同抗肿瘤作用。
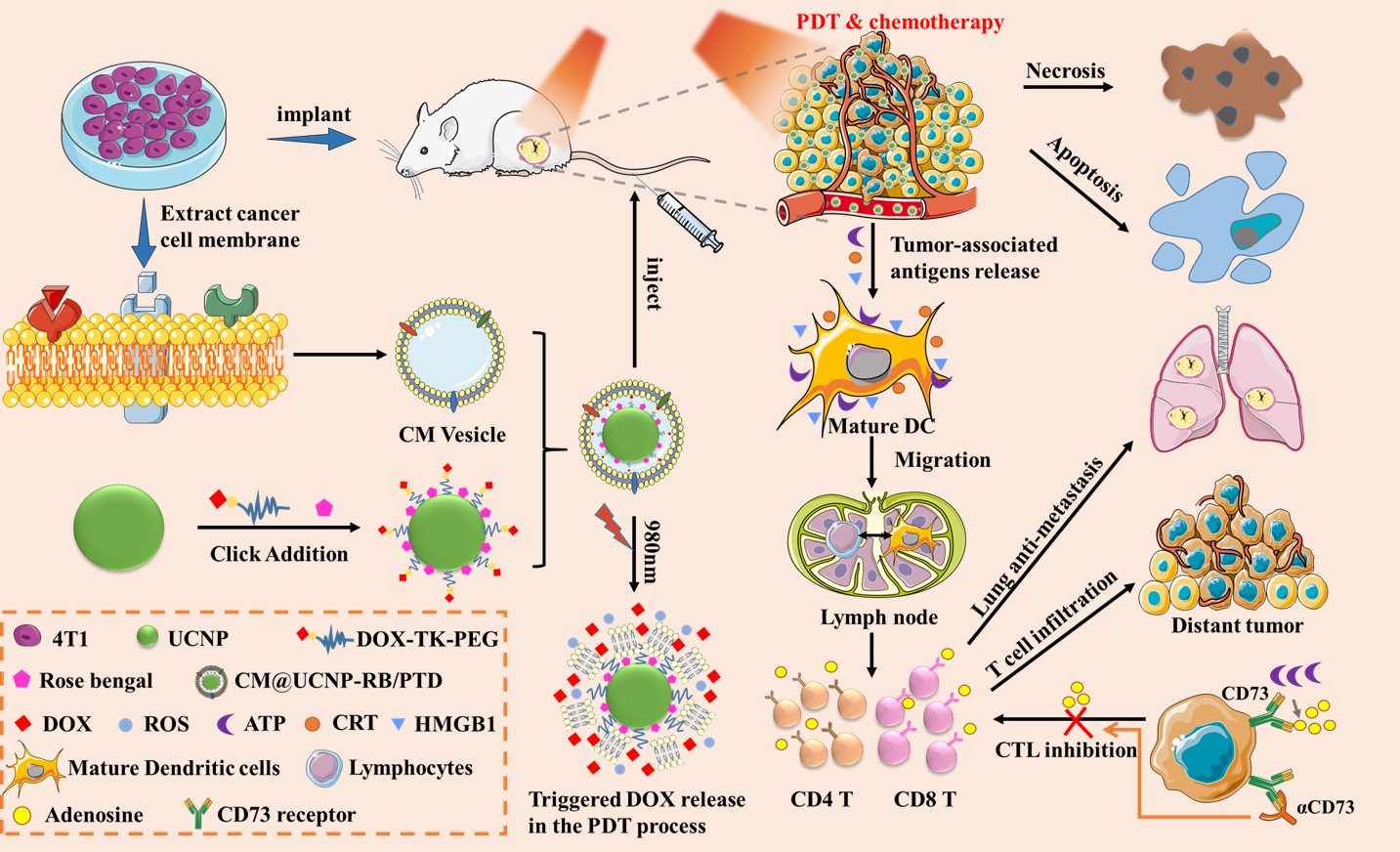
本研究利用癌细胞膜制备仿生上转换纳米粒以共载光敏剂与化疗药物阿霉素,并联用免疫检查点抑制剂CD73抗体,在体外近红外光照射下,实现深层光动力协同化疗的治疗效果,并缓解免疫抑制微环境,触发持久、全身性的抗肿瘤免疫反应。
本课题受到国家重点研发计划“政府间国际科技创新合作”项目和浙江省自然科学基金重大项目的支持。本文第一作者为我院药物制剂研究所2017级博士生金斐旸,通讯作者为浙大药学院杜永忠教授和浙大丽水医院纪建松教授。


