转化医学研究院陈静海/附属第二医院王建安课题组揭示长链非编码RNA在心脏代谢与心脏重构中的作用机制
心肌梗塞等缺血性心脏疾病是导致全球心血管疾病高死亡率和发病率的主要因素。心肌梗塞造成组织的局部缺血会引发心肌病,包括心肌收缩功能紊乱,纤维化疤痕的形成和心脏结构的重构。心脏重构反应不仅发生在梗死心肌层,还会引起梗死远端区异常的病理性心肌肥大并伴随能量代谢的重构如降低脂肪酸代谢增加糖酵解反应。代谢的重构导致ATP的含量减少,加速心脏损伤到心力衰竭发生的进程。心脏代谢的稳态调控是阻止缺血心脏不良重构的潜在治疗方法,然而长链非编码RNA参与心脏能量代谢调控的作用与机制知之甚少。
近日,浙江大学转化医学研究院/浙江大学医学院附属第二医院陈静海研究员、哈佛医学院波士顿儿童医院Da-Zhi Wang教授和浙江大学医学院附属第二医院王建安教授的联合团队在Basic Research in Cardiology 杂志发表LncRNA LncHrt preserves cardiac metabolic homeostasis and heart function by modulating the LKB1-AMPK signaling pathway的研究论文。报道了心肌细胞富集的长链非编码RNA LncHrt通过调节SIRT2-LKB1-AMPK 激酶信号级联反应,保护心梗后心脏能量代谢稳态,改善心脏缺血损伤后的结构与功能,揭示了新的基于RNA治疗的潜在靶点。

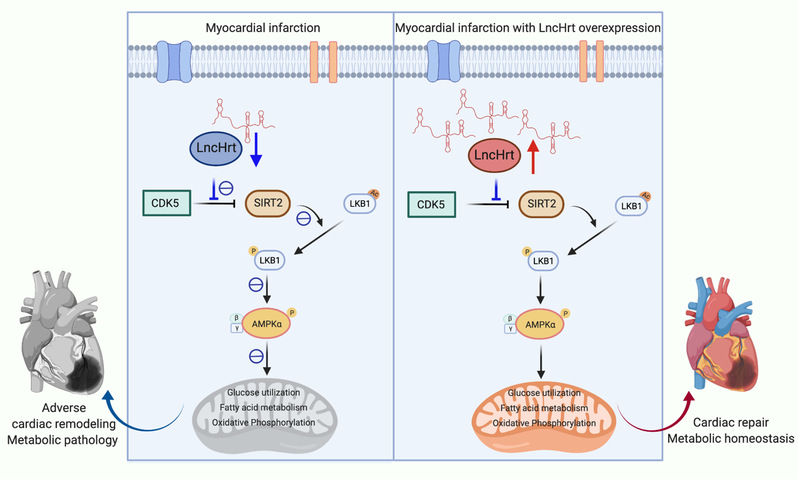
研究发现,在心梗后心脏中长链非编码RNA LncHrt表达显著下调,增加了CDK5与SIRT2的相互作用,并伴随着LKB1-AMPK信号通路的抑制。在心梗心脏中通过AAV9补偿LncHrt的表达,LncHrt通过干扰CDK5对SIRT2活性的抑制, 促进SIRT2下游的LKB1-AMPK信号通路的激活。激活的AMPK调控心脏的能量代谢稳态,进而缓解心梗后心脏的病理重构过程,保护心脏功能,阻止心力衰竭的发生。该研究鉴定了心肌富集的LncHrt为心脏代谢的调节分子,通过调控代谢信号通路,保护心脏损伤后的结构与功能。并且AAV9介导的LncHrt可以作为基于RNA治疗缺血性心脏疾病的有效靶点。
浙江大学转化医学研究院博士生刘宁、波士顿儿童医院Masaharu Kataoka博士和浙江大学智能创新药物研究院博士生王迎超为论文共同第一作者。陈静海研究员,Da-Zhi Wang教授和王建安教授为本论文共同通讯作者。研究工作得到国家重点研发计划、国家自然科学基金、浙江省自然科学基金和转化院种子基金等项目资助。
原文链接:https://doi.org/10.1007/s00395-021-00887-3


