浙大医学院李晓明教授课题组发现瑞特综合征恐惧记忆新机制
近日,浙江大学医学院李晓明教授课题组在《eLife》上在线发表了题为《MeCP2 in cholinergic interneurons of nucleus accumbens regulates fear learning》的研究论文。该研究发现伏隔核内胆碱能神经元上瑞特综合征基因MECP2调节恐惧学习的分子机制。该研究在瑞特综合征的发病机制方面有着新的突破,并且揭示了伏隔核在恐惧情绪中的重要功能。
浙江大学医学院博士生张颖、朱毅和曹淑霞博士为论文的共同第一作者,在实验室学习的医学院本科生潘浩奇,夏艳芳等参与了本项目的研究,李晓明教授为通讯作者。
瑞特综合征(Rett syndrome)是一种罕见的神经系统发育性疾病,1966年由奥地利医生Andreas Rett报道,并因此得名。MECP2基因编码的蛋白MeCP2是一种转录调节因子,MECP2基因因缺失/突变丧失功能可导致瑞特综合征。通过对瑞特综合征模型小鼠的研究发现,在不同脑区或者不同神经元类型中敲除MECP2基因可以造成瑞特综合征的不同表型。但是,MECP2基因如何调控学习记忆仍不明确。
为了解决这一科学问题,李晓明教授团队的研究生首先发现在小鼠胆碱能神经元(cholinergic neurons)中特异性敲除MeCP2蛋白能够引起小鼠恐惧学习能力的降低。并且,在伏隔核(Nucleus Accumbens)特异性恢复MeCP2表达能够恢复小鼠的恐惧学习能力,而不是基底前脑。这表明伏隔核的胆碱能中间神经元中MeCP2蛋白缺失导致敲除小鼠恐惧学习能力的降低。
那么,伏隔核胆碱能神经元调节恐惧记忆的分子机制是什么呢?接下来,他们使用免疫组化、膜片钳技术,发现敲除小鼠中伏隔核内胆碱能神经元的自发活动降低,这是由于神经元中GABAA α2受体表达增加,因此神经元接受的抑制性输入变大所导致。
最后,他们利用光遗传学、药理遗传学以及RNA干扰技术恢复小鼠伏隔核内胆碱能神经元的自发活动,并且成功恢复小鼠的恐惧学习能力。
美国马里兰大学的Mary Kay Lobo教授认为,“作者使用了一系列精妙的实验操纵了敲除鼠和野生鼠伏隔核内胆碱能神经元的活动与alpha2-GABAA受体功能,阐明了在胆碱能神经元中敲除瑞特综合征MeCP2引起恐惧记忆损伤的机制。”“此研究揭示了伏隔核胆碱能中间神经元上Mecp2在恐惧学习与记忆过程中新的作用。”
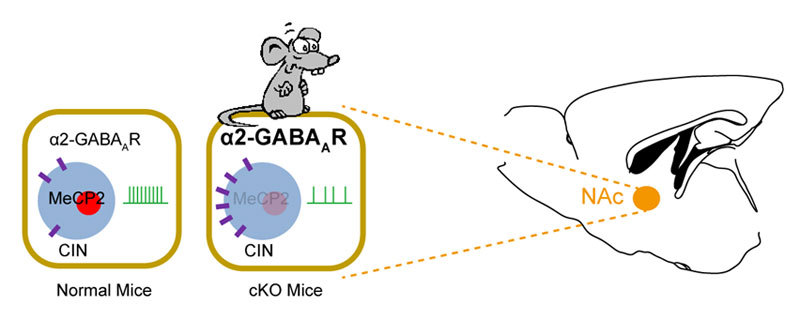
伏隔核胆碱能神经元内MeCP2调控恐惧情绪的模型示意图。


