转化医学研究院吕志民团队与周钦团队合作在Nature Communications发文揭示高酪氨酸血症的分子机制
高酪氨酸血症是由于酪氨酸代谢相关激酶的功能失调,导致大量代谢中间产物在体液、组织中积累,对大脑、脏器造成损伤的一种代谢性疾病。其中,4-羟基苯丙酮酸双加氧酶(HPD)是催化4-羟基苯丙酮酸(4-Hydroxyphenylpyruvic acid)形成尿黑酸(Homogentisic acid)过程中的关键激酶,该激酶突变、缺失或表达异常,会导致III型高酪氨酸血症的发生。临床上,Ⅲ型患者多有智力障碍、共济失调、腱反射增加、震颤、头小畸型和癫痫发作等神经系统症状。然而,关于HPD表达调控的分子机制至今未明。
2019年9月19日,浙江大学转化医学研究院吕志民团队和重庆医科大学检验医学院周钦团队合作,在Nature Communications上发表了HPD degradation regulated by the TTC36-STK33-PELI1 signaling axis induces tyrosinemia and neurological damage的研究论文。
文章揭示,在构建的基于TALEN技术敲除ttc36的小鼠中,小鼠血、尿液中的酪氨酸水平显著升高;尾静脉注射ttc36过表达质粒后,敲除小鼠血中酪氨酸水平显著下降。该现象首次提示TTC36参与调节小鼠的酪氨酸代谢。进一步分析发现,ttc36缺失会导致小鼠肝、肾组织中的HPD蛋白表达显著下降,但hpd mRNA水平却无明显变化;作者同时发现,TTC36与HPD存在相互作用,这些结果表明TTC36可能通过转录后修饰调控HPD的表达量,进而影响酪氨酸代谢。体内、外敲除ttc36基因后,HPD暴露出382位苏氨酸残基,该残基可被丝氨酸/苏氨酸蛋白激酶33(STK33)磷酸化,磷酸化的HPD蛋白(p-HPD T382)可被E3泛素连接酶PELI1泛素化后降解。HPD降解后酪氨酸代谢受阻,琥珀酰丙酮等代谢中间产物积累,ttc36 敲除小鼠表现出类似于人类III型高酪氨酸血症的临床症状,如学习、记忆能力下降等神经系统损伤表型。
本文利用小鼠模型、行为学分析及分子生物学等技术手段,揭示了TTC36与HPD相互作用以及调控STK33、PELI1降解HPD的分子机制,首次系统阐释了TTC36-STK33-PELI1信号轴在酪氨酸代谢及其中间产物对神经损伤的重要性(图1)。
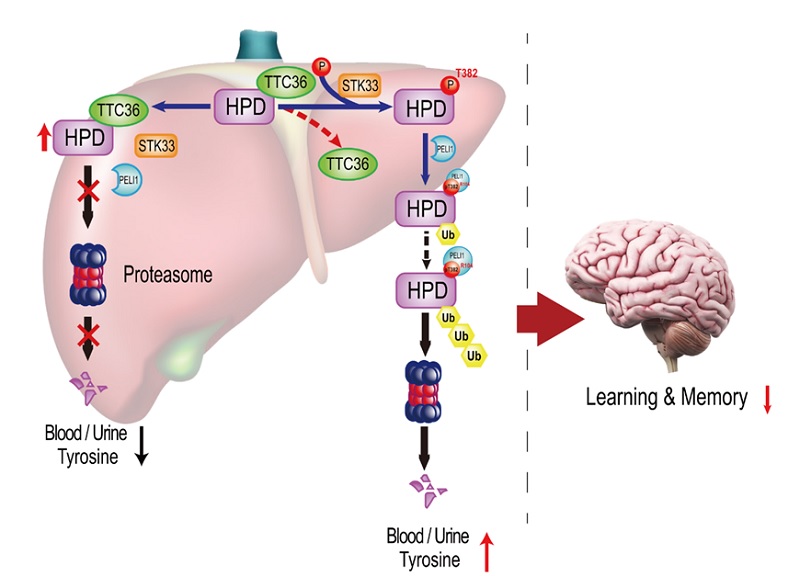
图1. TTC36-STK33-PELI1降解HPD的模式图


