段树民、高志华团队在《Cell Reports》发文揭示抑制性和兴奋性突触在突触囊泡产生与功能调控上的差异及机制
脑内神经细胞(神经元)通过突触“发号施令”(释放神经递质),调控下游细胞的活动。根据神经元颁布“指令”的不同,将神经元分为两类:如发布“加油令”加强下游细胞活动的兴奋性神经元和颁布“刹车令”削弱下游细胞活动的抑制性神经元。突触(synapse)是神经元间互联互通的关键节点,兴奋性神经元的“加油令”主要通过兴奋性突触—“油门”释放谷氨酸等兴奋性递质;而抑制性神经元的“刹车令”则主要通过抑制性突触—“刹车”释放γ-氨基丁酸(GABA)等抑制性递质,从而调节下游细胞的的活动。只有通过脑内数以兆亿(1014)计的 “油门”与“刹车”间紧密的协调和平衡,人脑这一史上最复杂机器才能得以正常运作。“油门”与“刹车”任意环节的功能失衡,都可能诱发癫痫、抑郁、精神分裂症等多种神经精神类疾病。因此“油门”与“刹车”的结构与功能差异一直以来都是神经科学的研究热点。
已知神经元“指令”—神经递质储存在突触前一群直径范围在40-60 nm左右的小泡,即突触囊泡内。当(突触前)神经元放电时,突触囊泡内递质释放,“指令”被下游(突触后)细胞感知并执行。递质一经释放,会通过快速的突触囊泡回收、循环再利用等机制来保障持续有效的突触传递。一般认为,兴奋性突触(油门)与抑制性突触(刹车)释放的指令和突触后感受器存在差异,而突触囊泡的产生、释放和再循环等动力学方面是否存在差异颇有争议。
为了探究兴奋性突触与抑制性突触在突触囊泡形成、回收、利用等方面是否存在差异,浙江大学基础医学院神经科学研究中心段树民和高志华团队结合多种前沿电镜成像手段,包括冷冻电镜断层扫描技术(cryo-electron tomography)、高压冷冻制样技术(High pressure frozen)与聚焦离子束扫描电镜技术(focused ion beam scanning electron microscope),发现参与学习与记忆调控的关键脑区—海马中的兴奋性(谷氨酸能)和抑制性(GABA能)突触无论是在囊泡大小还是形态上都具有较大差别:兴奋性突触囊泡一般小而圆,而抑制性突触囊泡则相对大而扁。通过HRP标记示踪后透射电镜成像手段,博士研究生李霞、覃丽明等发现这些囊泡采用不同的回收方式进行再循环利用,使得两类突触囊泡组分的超微结构和释放动力学存在不同。通过共聚焦和超高分辨率荧光显微成像技术,他们还发现溶酶体的蛋白水解酶cathepsin D选择性分布于GABA能突触前的内吞体(presynaptic endosomes),并调控GABA能突触囊泡的再生和突触传递过程。有意思的是,cathepsin D突变会导致一种临床上称为“溶酶体堆积病”的疾病,患者出现神经系统和其他多器官的功能退变和异常。该研究首次发现cathepsin D的功能缺陷会导致GABA能突触前内吞体的功能异常,进而选择性损害GABA能突触的功能。该研究不仅解析了兴奋性与抑制性突触囊泡在结构与动力学等方面存在的差异及其调控机制,也为解释cathepsin D相关疾病出现神经系统兴奋-抑制失衡的神经病理症状提供了基础 (图1)。鉴于溶酶体与内吞体之间的紧密联系,研究还提出了“溶酶体堆积病”可能也是“内吞体堆积病”的新概念。
以上研究结果以“Presynaptic endosomal Cathepsin D regulates the biogenesis of GABAergic synaptic vesicles”为题,于2019年7月23日在《Cell Reports》在线发表。该研究得到了中国科学院生物物理研究所徐涛院士、中国科学技术大学毕国强教授及浙江大学医学院陈忠教授的帮助,受到国家自然科学基金、国家重点基础研究发展计划(973计划)、中央大学基础研究经费和中国教育部111项目等资助。博士生李霞、覃丽明、李叶菲、余昊为论文的共同第一作者,高志华副教授和段树民教授为该论文共同通讯作者。
论文链接:https://doi.org/10.1016/j.celrep.2019.06.006
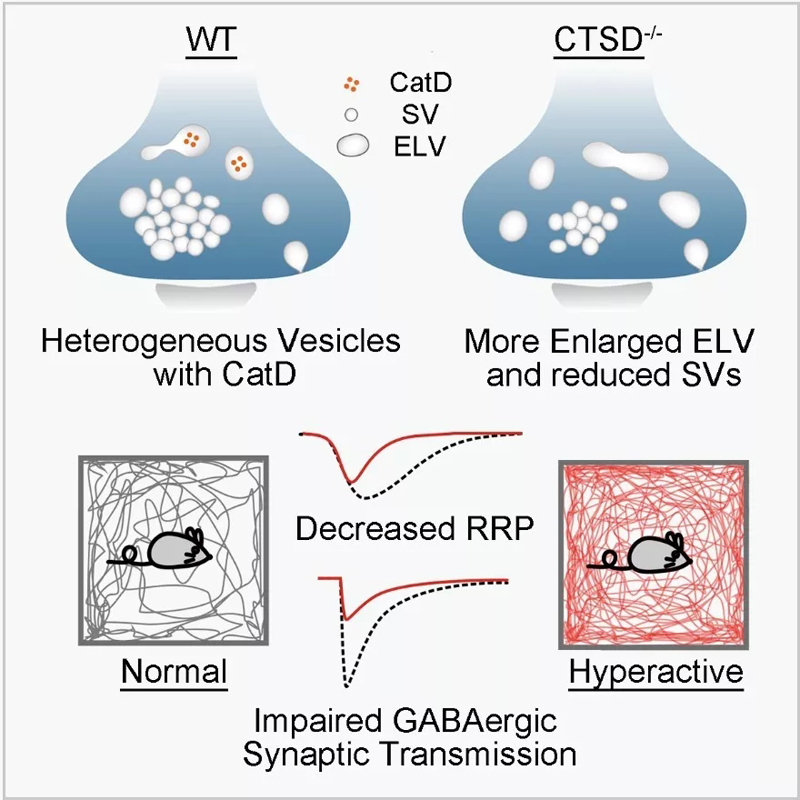
图1:CatD调控GABA能突触囊泡再生和突触传递功能模式图


