吕志民团队《Science advances》发文:揭示肝癌细胞代谢特征
4月24日,国际学术期刊Science advances(《科学进展》)在线发表了吕志民团队的最新研究成果“The protein kinase activity of fructokinase A specifies the antioxidant responses of tumor cells by phosphorylating p62”。该研究发现,果糖激酶(KHK)基因异常的选择性剪接,会导致正常肝细胞与肝癌细胞对氧化应激响应的差异和清除活性氧(ROS)能力的不同。肝癌细胞中特异表达的果糖激酶KHK-A,可以响应氧化应激信号进而发挥蛋白激酶功能,磷酸化自噬受体p62并促进其寡聚化,最终通过激活Keap1-Nrf2 信号通路促进肝癌细胞在氧化压力条件下的存活。
肿瘤细胞的代谢重编程往往导致其产生过多的ROS并处于氧化应激状态。由于ROS自身具有很强的氧化活性, 能够和细胞内的生物大分子如核酸、磷脂和蛋白质等反应产生细胞毒性,因此,细胞内累积的ROS如果不能及时清除,则会引起细胞的损伤甚至死亡。Nrf2是目前已知的调节体内氧化应激,进行自我保护的最重要转录因子之一。在氧化应激条件下,Nrf2可以进入细胞核并促进一系列细胞保护因子的转录,从而保护细胞免于ROS积累导致的细胞死亡。Keap1是Cullin3 E3泛素连接酶复合物的底物衔接蛋白,也是Nrf2在胞浆中的结合蛋白,能抑制Nrf2活性,促进Nrf2泛素化并被蛋白酶体降解。然而,肿瘤细胞和正常细胞对于氧化应激响应的不同以及ROS清除调控机制的差异目前还不明确。
吕志民研究团队证实,在相同的氧化应激刺激条件下(低氧等),肝癌细胞的ROS累积及其诱导的细胞死亡显著低于正常肝细胞,同时,肝癌细胞生成了更多的参与抗氧化的还原剂,如NADPH、GSH等。这提示肝癌细胞可能具有区别于正常细胞的特有的抗氧化防御体系,以维持其在氧化应激条件下的存活。吕志民研究团队之前发现 (Nature Cell Biology, 2016),相比于正常肝细胞,肝癌细胞中的果糖代谢水平明显降低。果糖激酶(KHK)基因异常的选择性剪接,会造成其在正常肝组织及肝肿瘤中的差异性表达,即肝癌细胞主要表达丧失了加工果糖能力的KHK-A;相反地,正常肝细胞主要表达的KHK-C则具有较高的果糖代谢酶活性。那么正常肝细胞和肝癌细胞对果糖利用的差异是否与它们清除活性氧(ROS)能力的不同存在潜在的联系呢?该研究团队惊奇地发现,KHK-A, 而不是KHK-C,对于肝癌细胞清除ROS和抵抗氧化应激是不可或缺的。
在氧化应激的条件下, KHK-A的 S80位点被活化的AMPK磷酸化。经质谱分析,磷酸化的KHK-A发生构象改变后会与自噬受体p62相互作用。“存在即合理”, 既然肝癌细胞特异性表达的KHK-A丧失了果糖激酶原本应有的代谢激酶活性,那么是否它可以作为蛋白激酶参与氧化应激通路的调控呢?吕志民实验室发现,S80磷酸化可以作为KHK-A获得蛋白激酶活性的开关,使其磷酸化 p62的S28位。值得一提的是,在KHK-A蛋白上高度保守的S80,在KHK-C亚型上却并不存在,这导致KHK-C无法结合和磷酸化p62,这是KHK-A和KHK-C对氧化应激信号响应存在差异的根本原因。进一步的研究显示,磷酸化的p62 有助于其发生寡聚化,在细胞内呈现点状化聚集。作为重要的自噬受体,寡聚的p62结合Keap1形成聚合物(自噬体), 可有效降低 Keap1与Nrf2的结合能力, 形成的聚合体更容易通过自噬途径被清除, 从而降低Keap1水平及其结合 Nrf2的能力, 导致Nrf2入核的增加以及Nrf2介导的抗氧化酶基因的转录,最终使得ROS得以有效清除并保证肝癌细胞在氧化应激条件下的存活。更重要的是,利用CRISPR/Cas9技术将肝癌细胞中野生型KHK-A和p62分别突变成KHK-A S80A和p62 S28A均可以有效抑制p62的寡聚化和点状化,从而抑制p62-Keap1-Nrf2信号通路的激活,因此,积累的ROS无法被及时清除进而导致细胞死亡。 在动物水平,抑制KHK-A介导的p62的磷酸化可以有效抑制肝癌的发生发展和细胞增殖。 利用肝癌的临床标本,KHK-A S80, p62 S28的磷酸化水平被发现与Nrf2的细胞核定位丰度正相关,此外,KHK-A S80, p62 S28的磷酸化水平较高的肝癌患者的预后较差,生存期降低。 综上所述,该项研究从分子机制角度详尽阐明了肝癌细胞中特异表达的KHK-A作为蛋白激酶对p62-Keap1-Nrf2信号通路的调控网络;从理论上说明了果糖激酶(KHK)基因异常的选择性剪接,是正常肝细胞与肝癌细胞对氧化应激的差异响应和清除ROS能力不同的重要原因; 从病理意义上揭示了靶向抑制KHK-A蛋白激酶活性可以作为今后治疗肝癌的潜在方法。
该研究成果由吕志民在MD Anderson 癌症中心和浙江大学转化医学研究院团队和温州医学院吕建新团队以及第二军医大学王红阳院士团队合作完成。
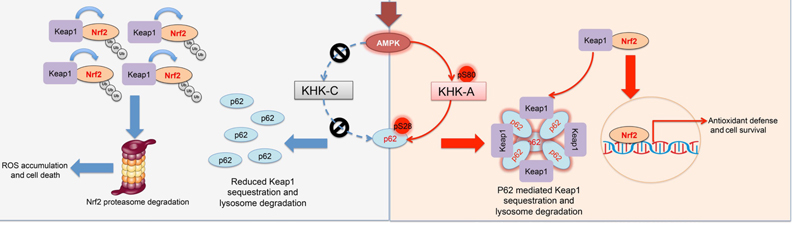
图1. 肝癌细胞特异性表达的KHK-A与正常肝细胞中表达的KHK-C对氧化应激不同响应的示意图


