管敏鑫教授课题组在Nucleic Acids Research发表研究成果揭示线粒体tRNA修饰基因GTPBP3缺陷导致肥厚型心肌病的致病机理
2019年3月27日,国际权威学术期刊Nucleic Acids Research在线发表了生殖遗传教育部重点实验室副主任、浙江大学遗传学研究所管敏鑫教授课题组对线粒体tRNA修饰基因GTPBP3的最新研究成果(原文链接https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkz218/5420541?searchresult=1),该研究利用CRISPR/Cas9技术构建的斑马鱼模型,系统阐述了线粒体tRNA修饰缺陷引起线粒体功能障碍,最终导致肥厚型心肌病的分子致病机制。
线粒体是细胞中的“能量工厂”,通过氧化磷酸化为生命过程提供ATP。心脏是人体最重要的器官之一,它为人体血液循环提供源动力,因而能量需求巨大。肥厚型心肌病是一种原因不明的心肌疾病,特征为心室壁呈不对称性肥厚,可导致运动性猝死。近年来基因筛查研究显示,GTPBP3基因突变与肥厚性心肌病相关,但是具体的致病机理还未明确。GTPBP3(GTP binding protein 3)蛋白是一种高度保守的线粒体tRNA转录后修饰酶,最早由管敏鑫团队在2002年发现(Mol Cell Biol. 2002)。
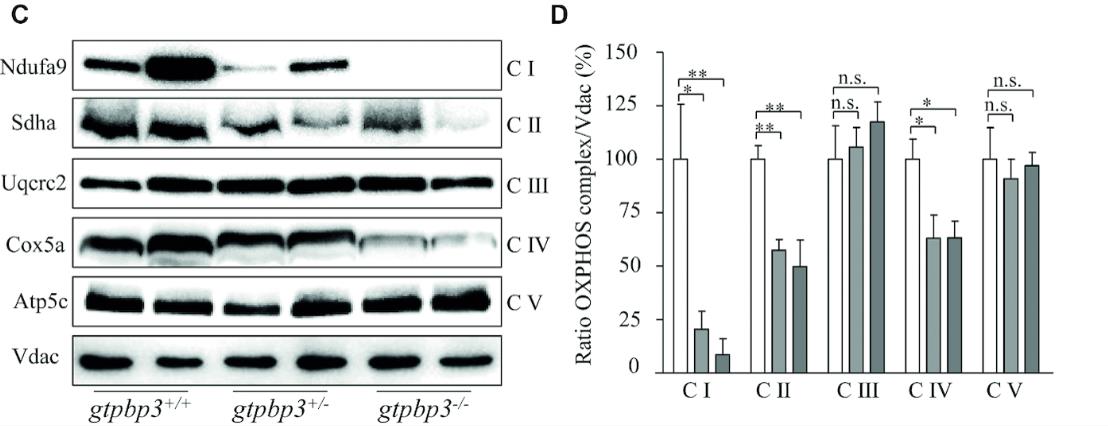
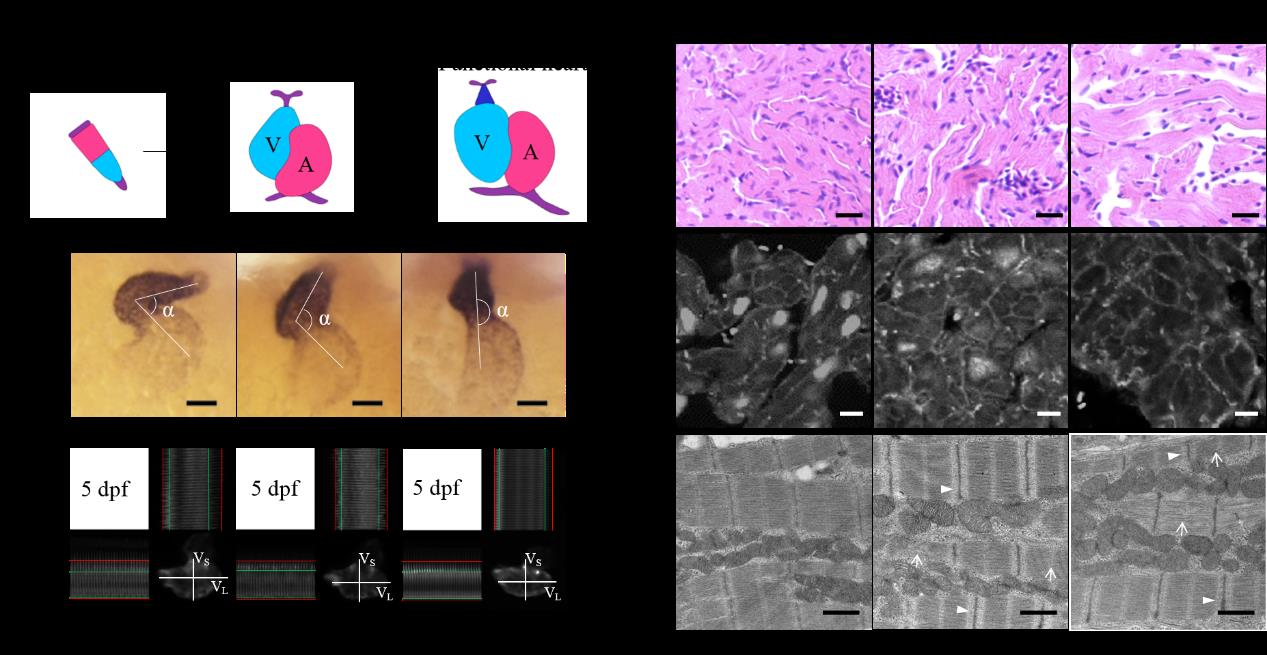
在本研究中,团队成员利用CRISPR/Cas9技术构建了gtpbp3基因稳定敲除的斑马鱼模型,发现该基因敲除的斑马鱼胚胎心脏发育迟缓,收缩功能降低,成年突变体的心肌细胞体积增大,线粒体功能严重受损。团队成员利用生物化学分析方法,首次检测到突变体中与Gtpbp3蛋白修饰相关的tRNA发生泳动位移,与对照相比更容易被S1核酸酶降解,提示转录后修饰异常影响tRNA的结构稳定性。由于结构变化,tRNA在蛋白质翻译过程中不能有效地识别密码子,其在核糖体上的滞留时间延长,导致线粒体tRNA氨基酰化水平整体升高。线粒体tRNA代谢的紊乱影响了线粒体蛋白质翻译,造成线粒体蛋白质内稳态压力,最终导致线粒体呼吸链功能受损,能量供应不足,累及心脏的发育和功能。
该研究工作获得国家重点基础研究发展计划(973计划),国家自然科学基金以及博士后科学基金等项目的支持。遗传学研究所博士生陈丹妮和张增明为文章的共同第一作者,生殖遗传教育部重点实验室副主任、浙江大学遗传学研究所管敏鑫教授为本文通讯作者。
图一:斑马鱼gtpbp3基因突变引起相关线粒体tRNA发生泳动位移(A),对S1核酸酶敏感性增加(B),造成线粒体呼吸链复合体稳定性下降(C, D)。
图二:gtpbp3基因突变体斑马鱼胚胎心脏发育迟缓,收缩功能降低(A-C),成年突变体表现出心肌肥厚表型(D-F)。