孙启明课题组在《Molecular Cell》发文揭示自噬体成熟和脂代谢调控的新机
2019年1月28日,浙江大学医学院孙启明课题组在Molecular Cell在线发表了题为Pacer is a mediator of mTORC1 and GSK3-TIP60 signaling in regulation of autophagosome maturation and lipid metabolism 的文章,该工作阐明了脊椎生物特有的自噬调控基因Pacer如何感知上游营养信号,进而调控自噬体成熟和脂代谢的分子机制。

Pacer(protein associated with UVRAG as autophagy enhancer)是孙启明课题组新近鉴定的一个脊椎动物特有的自噬调控分子,相关工作2017年发表在Mol Cell杂志上。Pacer一方面能直接与PI3KC3复合物亚基之一的UVRAG蛋白直接相互作用,从而解除Rubicon(PI3KC3复合物亚基,自噬负调控因子)对Vps34激酶的抑制作用。另一方面,Pacer能将PI3KC3和HOPS复合物亚基招募到自噬膜泡上,进而促进自噬体和溶酶体的融合。
自噬是基于溶酶体的胞内降解途径,对维持细胞的稳态有重要作用。自噬能够快速响应代谢信号的变化,过去的研究相对集中于自噬起始阶段的调控机制,而对自噬晚期的机制了解较少。mTOR在自噬调控中发挥着重要作用。在营养丰富状态下,mTOR可磷酸化自噬早期蛋白分子如ULK1、ATG13、ATG14,Ambra1、NRBF2和WIPI2等,抑制自噬体的形成。虽然mTOR调控自噬起始阶段有了较为系统的研究,但是人们对mTOR介导的自噬晚期阶段的调控了解较少。另外,营养缺乏的条件下,GSK3磷酸化TIP60/KAT5,后者进而乙酰化ULK1,进而激活自噬。GSK3-TIP60通路对自噬的调节具有较高的保守性。在酵母细胞中,TIP60乙酰基转移酶的同系物,Esa1p,其可以乙酰化自噬早期蛋白Atg3,进而增强Atg3和Atg8的相互作用,这一机制有助于自噬早期结构隔离膜的延伸。无论是ULK1还是Atg3,都是早期自噬体形成的调节因子。尚不清楚GSK3-TIP60信号通路是否调控自噬溶酶体成熟。
在最新的这项研究中,研究人员发现在营养丰富状态下,mTOR磷酸化Pacer,进而抑制Pacer与Stx17和HOPS亚基的相互作用,自噬溶酶体的形成;在营养匮乏状态下,Pacer发生去磷酸化,从而可以接收激活的GSK3-TIP60信号而发生乙酰化。乙酰化的Pacer可以更高效地招募HOPS复合物,从而促进自噬溶酶体的形成和肝细胞的脂质代谢(见图)。
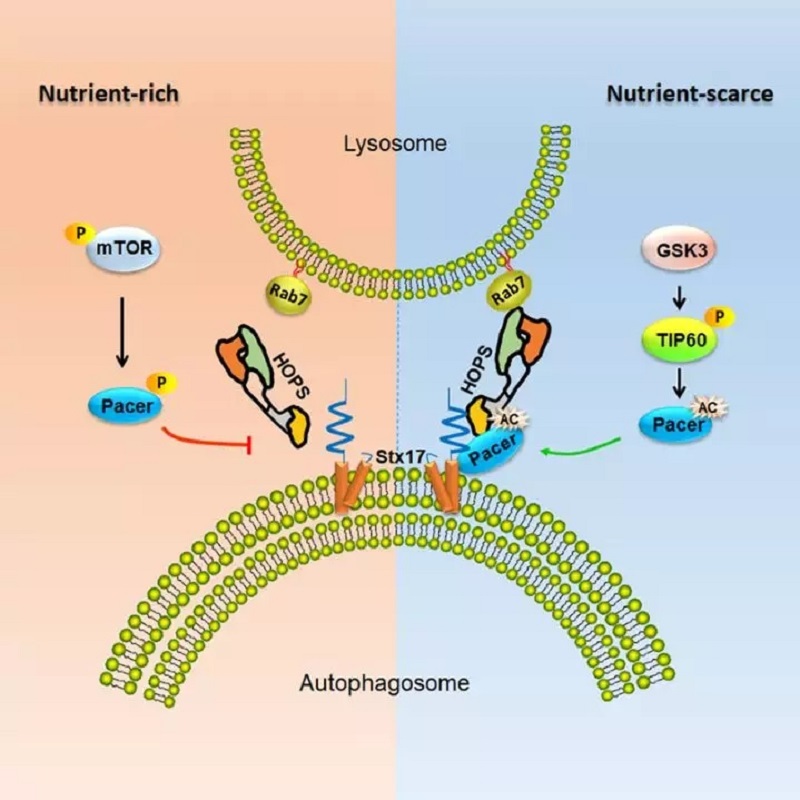
该工作阐明了脊椎生物特有的自噬调控基因Pacer如何感知上游营养信号,进而调控自噬体成熟和脂代谢的分子机制。这一发现为上游代谢信号调控自噬晚期阶段提供了一个具有较高理论价值的范例。
据悉,该工作主要由浙江大学基础医学院及浙大附属第二医院孙启明课题组完成,程侠卫博士(课题组博后)是论文的第一作者,孙启明研究员是该论文通讯作者。北京生命科学研究所沈志荣、李琳和陈涉研究员,浙江大学基础医学院刘伟教授和刘婷研究员以及浙江大学附属第二医院龚渭华教授为这个工作的完成提供了大力支持。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)31071-2


