王福俤教授团队发现“铁死亡”是心脏疾病发生的关键新机制
近日,国际权威学术期刊《美国科学院院报》(PNAS)在线发表了浙江大学公共卫生学院王福俤教授团队题为“Ferroptosis as a target for protection against cardiomyopathy”的研究论文,首次揭示抗癌药物阿霉素(DOX)诱导的心肌病和缺血再灌注(Ischemia/Reperfusion, I/R)诱发的心脏损伤中存在新型细胞死亡类型“铁死亡”;阐明了其分子调控机制并研究发掘5种预防心脏损伤的有效途径,包括铁死亡抑制剂Fer-1、铁螯合剂DXZ、线粒体抗氧化剂MitoTEMPO、血红素加氧酶(Hmox1)特异性抑制剂锌原卟啉(ZnPP)以及低铁膳食,这一里程碑式重大发现为心肌病及心肌梗死等致死性心脏疾病的防治提供了崭新策略。

心脏疾病已经成为健康领域亟待解决的重要问题之一。作为一种终末分化细胞,心肌细胞的死亡将导致心肌细胞数量的减少,从而引起心脏结构和功能上的缺陷,加剧心力衰竭。因此,心肌细胞死亡的调控通路具有重大的研究价值与临床转化意义。细胞死亡不仅是所有细胞的最终命运,而且它与细胞分裂、增殖等生命现象一样,在整个机体的正常运转以及病理生理过程中具有不可替代的作用。长期以来,细胞死亡方式主要分为经典的坏死(Necrosis)和凋亡(Apoptosis)两大类型。然而,随着对细胞死亡机制的深入研究,程序性坏死(Necroptosis)、自噬(Autophagy)、铁死亡(Ferroptosis)、焦亡(Pyroptosis)、Parthanatos等多种新的细胞死亡方式被相继发现。心脏疾病存在的细胞死亡类型还存在许多争议。
为了深入研究心脏疾病中细胞死亡的作用,在王福俤教授和闵军霞教授指导下,方学贤博士采用多种细胞死亡抑制剂处理以及细胞死亡通路相关基因敲除小鼠发现,只有“铁死亡”特异性抑制剂Ferrostatin-1(Fer-1)可以显著降低DOX导致的心脏毒性并有效提高小鼠存活率,揭示心肌损伤的重要机制是“铁死亡”。
“铁死亡”是一种铁依赖的脂质过氧化引发的新型细胞死亡方式。研究表明“铁死亡”在癌症、神经退行性疾病和器官损伤等病理生理学过程中发挥着非常重要的作用。王福俤团队此前曾利用多种铁过载基因敲除小鼠模型(Hjv及Smad4敲除)揭示高铁处理可诱导肝脏“铁死亡”发生,进一步确认Slc7a11是调控“铁过载-铁死亡”的关键基因,研究成果以封面论文发表在2017年Hepatology。
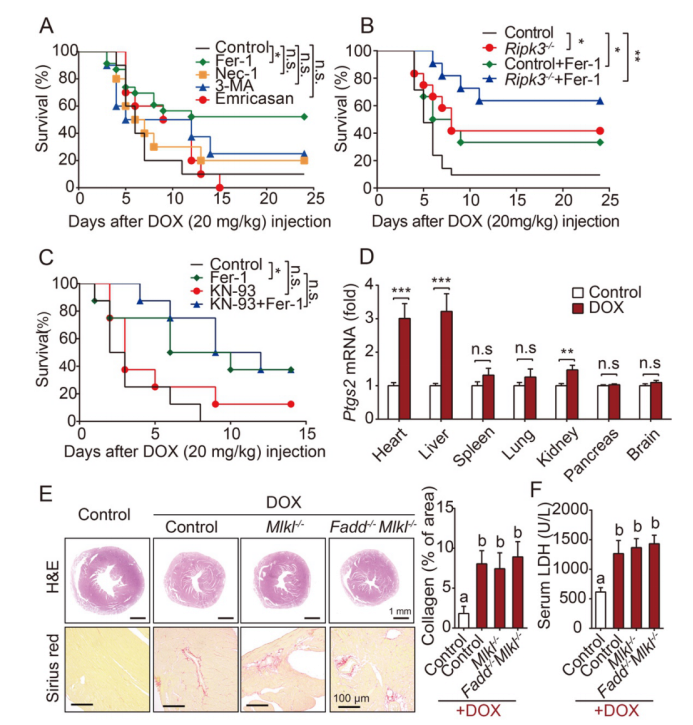
铁死亡抑制剂可有效抑制DOX诱发的致死性心脏损伤(PNAS, Fig1)
为了寻找DOX心肌病模型中铁死亡发生过程的关键调控因子,方博士通过RNA-seq发现:血红素加氧酶-1(Hmox1)的显著上调可能参与其中。进一步研究发现,使用Hmox1抑制剂可明显缓解DOX小鼠心脏中铁死亡的发生发展,并保护心脏功能;反之,加载血红素诱导Hmox1过表达则效果相反。
那么Hmox1介导心肌细胞“铁死亡”的机制是什么呢?Hmox1是铁卟啉化合物血红素分解代谢过程中的限速酶,可将血红素分解为一氧化碳、胆绿素和二价铁离子,而心肌含有丰富的血红素用以合成肌红蛋白、细胞色素等。阿霉素注射后,小鼠被检测到血红素降低,铁和胆红素(胆绿素的氧化产物)水平升高;而使用Hmox1抑制剂或者敲除上游调控分子Nrf2均可减轻心肌细胞铁蓄积。因此,Hmox1的激活介导自由铁离子从血红素中释放出来,蓄积在心肌细胞从而诱发了“铁死亡”。
有研究提示“铁死亡”是通过细胞膜或者细胞器膜发生脂质过氧化损伤来杀伤细胞,但具体的亚细胞定位一直存在争议。研究人员首先通过对DOX处理小鼠心脏组织进行透射电镜观察,发现DOX小鼠的线粒体形态发生明显变化,进一步实验发现ATP生成与线粒体膜电位均显著下降;而这些变化均能被Fer-1所抑制。进而分离心肌线粒体后发现,铁蓄积和脂质过氧化在DOX作用后主要发生在心肌细胞的线粒体而不是细胞胞质中。相较于传统的抗氧化剂TEMPO,使用线粒体特异性抗氧化剂MitoTEMPO可以有效抑制“铁死亡”,保护心脏功能,从而更加明确了线粒体损伤与心脏损伤在DOX模型中的因果关系。
此外,运用另一种经典的心脏损伤模型,即小鼠在体(in vivo)心肌缺血再灌注(I/R)损伤,同样发现“铁死亡”的存在。给予“铁死亡”抑制剂阻断铁死亡可明显减轻缺血再灌注导致的急性和慢性心脏损伤,为临床上心肌梗死等心脏疾病提供了非常有前景的新思路和新策略。
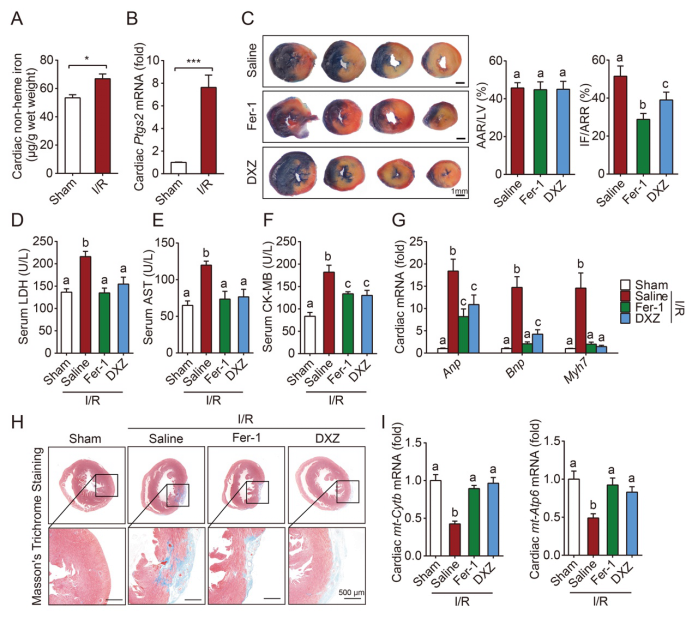
抑制“铁死亡”可有效改善缺血再灌注心脏损伤(PNAS, Fig6)
据悉,PNAS的匿名评审专家给予了该研究极高的评价,认为“这是一项设计精良的综合性研究,包含了大量的来自多种转基因小鼠模型和疾病模型的高质量数据”(This is a well-designed comprehensive study that contains large amount of high-quality data from multiple transgenic mouse lines and disease models);“无论对铁死亡还是心血管研究领域,这项研究意义重大”(The study is an important contribution to the fields on ferroptosis and cardiology)。
王福俤团队博士后方学贤为论文第一作者,公共卫生学院王福俤教授(Lead contact)、转化医学研究院闵军霞教授、美国哥伦比亚大学Wei Gu教授以及德国德累斯顿工业大学Andreas Linkermann教授为共同通讯作者。中国科学院上海营养与健康研究院杨黄恬教授、中国科学院生物物理所杨福全研究员以及浙江大学转化医学研究院陈静海研究员参与部分工作。北京生命科学研究所王晓东院士、北京大学肖瑞平教授、北京大学张岩副研究员、北京大学张博教授、中国科学院上海营养与健康研究院章海兵研究员、日本Masayuki Yamamoto 教授及中国医科大学皮静波教授提供了研究所需的部分动物模型。该成果得到了国家重点研发计划及国家自然科学基金的经费资助。
原文链接:https://www.pnas.org/content/early/2019/01/23/1821022116


