陈宝惠课题组在Nature Communications上发表活细胞染色质成像新方法
2018年11月29日,Nature Communications在线发表了浙江大学医学院陈宝惠课题组题为Efficient labeling and imaging of protein-coding genes in living cells using CRISPR-Tag的研究论文。该研究提出了一个新的非重复DNA序列的标记策略,在活细胞内实现了特异蛋白编码基因DNA元件与蛋白的高效双标记,从而为探索基因核内位置(gene positioning)与基因表达的关系奠定重要的技术基础。
在真核细胞中,基因组DNA以染色质的高级形式储存于细胞核的三维空间内,因此称“三维基因组”。三维基因组结构的异常与多种人类疾病的发生密切相关。基因组的三维结构是一个动态变化,且呈现单细胞异质性的结构。因此在活细胞状态下,采用单细胞分辨率来研究基因组三维结构的动态和功能尤为重要。三维基因组领域有非常多重要科学问题等待探索。例如,一个特定基因在细胞核内的位置由什么分子决定? 在哪些情况下,基因或调控元件会从细胞核的一个位置移动到另外一个位置?这种空间位置上的变化,是由哪些蛋白分子介导?这个发生位移的时间点是有规律并受某种机制控制的吗?这背后的生物学意义是什么?这一系列问题同样适用于三维基因组结构概念范畴里的任何一个方面,例如染色质环,拓扑关联结构域,染色体区室或染色体疆域等不同三维结构的形成。
近年来,活细胞DNA标记技术,作为研究基因组不可或缺的实时成像工具,受到了极大地关注。将核酸酶失活的Cas9,简称dCas9, 与荧光蛋白融合,经过系统改造优化后,可在人的活细胞中标记并实时追踪特异基因或特异调控元件在细胞核内的位置及动态变化。该技术可以在细胞分裂各个时期的多种细胞类型内进行基因组DNA特异标记,并能对目标元件进行长达十几个小时的动态观察,显示了该项技术可广泛性运用的前景。
虽然基于CRISPR-Cas9的活细胞DNA成像技术在最近几年得到了很大的发展,但是大部分工作还是局限于标记带重复序列的DNA片段。不含重复序列的基因标记还是存在很大的挑战。技术难点主要体现在:为了富集足够强的高于背景的信号,不含重复DNA序列的基因标记需要表达26-36个sgRNA。然而不同sgRNA的活性差异很大,虽然有不少预测sgRNA活性的设计软件帮助我们筛选靶点,但是仍然无法用之准确判断sgRNA在细胞内的活性。因此,不含重复序列的基因组位点,其标记效率比较低。本研究采用全新的策略,制作新的活细胞DNA标签,简称CRISPR-Tag(图一)。该标签的DNA序列来自线虫的基因组,在线虫体内能被Cas9高效切割。这些DNA序列不存在人类基因组里,但整合到人的基因组内也一样能被Cas9高效识别。因此CRISPR-Tag可以高效募集dCas9-FP荧光分子到特异的基因组位点进行DNA标记。另外,通过优化CRISPR-Tag的插入位点,巧妙地将其隐藏在荧光蛋白的内含子序列中,再将荧光蛋白DNA序列通过CRISPR敲入手段插入到目标蛋白编码基因的N端或C端。荧光蛋白的表达作为CRISPR敲入的报告分子,使这个系统能够快速建立,而且能同时实现目的基因的DNA和蛋白的双标记,且不影响靶蛋白的表达。这套工具理论上可适用于标记任何一个不带重复序列的蛋白质编码基因,不再受sgRNA活性限制。蛋白质编码基因是基因组上最主要的功能性元件。研究这类基因的核内位置变化与转录活性的关系,将极大丰富我们对三维基因组的认识。
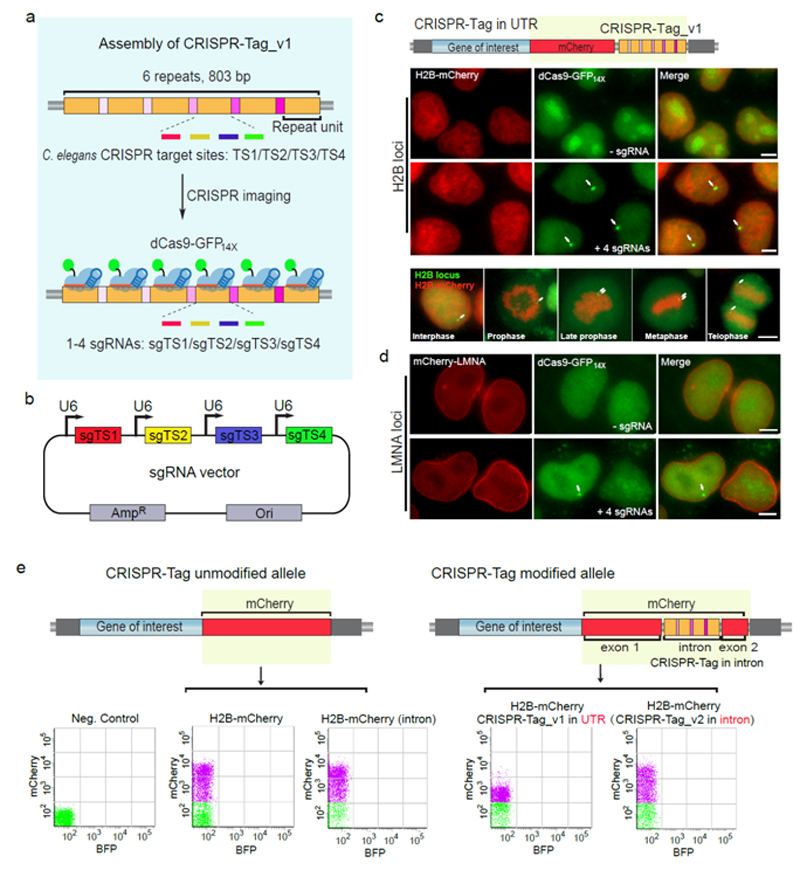
图一: 组装CRISPR-Tag标签,高效率实现活细胞内DNA与蛋白的双标记(Chen et al, Nat Commun. 2018)
浙江大学医学院细胞生物学系/浙江大学血液研究所的陈宝惠研究员为该研究的第一作者,陈宝惠研究员和美国加州大学旧金山分校的黄波教授为该研究的通讯作者。参与该研究的作者还有陈宝惠课题组的硕士生徐海月、博士生梁鹰和浙江大学转化医学研究院的邹炜研究员。
链接:https://www.nature.com/articles/s41467-018-07498-y


